
【题目】汽车安全气囊弹出时的反应为:![]() 下列说法正确的是( )
下列说法正确的是( )
A.自然界中氮、钠、硅元素均可以游离态形式存在
B.将反应后的固体溶于适量水,静置,通入![]() ,无现象
,无现象
C.微粒的半径:![]()
D.若反应中转移![]() 电子,则消耗
电子,则消耗![]() 的质量为
的质量为![]()
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】将0.4mol N2气体和1mol H2气体在2L固定的容器内混合,在一定条件下发生反应:N2(g)+3H2(g)2NH3(g),若2min后测得NH3的浓度为0.2molL-1,
(1)2min时H2的转化率为______。
(2)2min时三种气体的总量为_____mol。
(3)相同温度下,若2min后该反应达平衡,则反应前后的气体压强比为___ 。
(4)下列措施能增大反应速率的是___(填字母)。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ:
化学键 | H-H | N-H | N≡N |
键能kJ/rmol | 436 | a | 945 |
试根据表中所列键能数据计算a的数值______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Cu、Mn三种元素的单质及化合物在生产、生活中有广泛应用.
![]()
![]() 是一种多功能材料,工业上常以
是一种多功能材料,工业上常以![]() 和尿素
和尿素![]() 、氧化剂等为原料制备.尿素分子中碳原子的杂化轨道类型为 ______ ,lmol尿素分子中含有的
、氧化剂等为原料制备.尿素分子中碳原子的杂化轨道类型为 ______ ,lmol尿素分子中含有的![]() 键数为 ______ .
键数为 ______ .
![]() 某学习小组拟以废旧于电池为原料制取锰,简易流程如下:
某学习小组拟以废旧于电池为原料制取锰,简易流程如下:
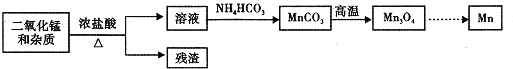
![]() 用浓盐酸溶解二氧化锰需保持通风,原因是 ______
用浓盐酸溶解二氧化锰需保持通风,原因是 ______ ![]() 用化学方程式表示
用化学方程式表示![]() .
.
![]() 写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 ______ .
写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 ______ .
![]() 基态铜原子的电子排布式为 ______ ,与Cu同周期且原子序数最小的第Ⅷ族元素,其基态原子核外有 ______ 个未成对电子.
基态铜原子的电子排布式为 ______ ,与Cu同周期且原子序数最小的第Ⅷ族元素,其基态原子核外有 ______ 个未成对电子.
![]() 图1是
图1是![]() 的晶胞结构,晶胞的边长为
的晶胞结构,晶胞的边长为![]() 则
则![]() 的密度为 ______
的密度为 ______ ![]() 用
用![]() 表示阿伏加德罗常数的值
表示阿伏加德罗常数的值![]() .
.
![]() 绿矾
绿矾![]() 是补血剂的原料,保存不当易变质.请设计实验检验绿矾是否完全变质 ______ .
是补血剂的原料,保存不当易变质.请设计实验检验绿矾是否完全变质 ______ .
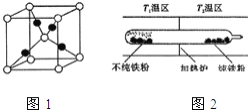
![]() 以羰基化合物为载体,提纯某纳米级活性铁粉
以羰基化合物为载体,提纯某纳米级活性铁粉![]() 含有一些不反应的杂质
含有一些不反应的杂质![]() ,反应装置如图
,反应装置如图![]() 已知:
已知:![]() ,常压下,
,常压下,![]()
![]() 的熔点约为
的熔点约为![]() ,沸点为
,沸点为![]() ,则
,则![]()
![]() 的晶体类型为 ______
的晶体类型为 ______ ![]() 请用平衡移动原理解释
请用平衡移动原理解释![]() 的原因 ______ .
的原因 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术]粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
(1)粉煤灰研磨的目的是_______________________。
(2)第1次过滤时滤渣的主要成分有__________、__________(填化学式,下同),第3次过滤时滤渣的成分是__________。
(3)在104℃用硫酸浸取时,铝的浸取率与时间关系如图1,适宜的浸取时间为__________h;铝的浸取率与![]() 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在![]() 相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。
相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。

(4)流程中循环使用的物质有__________。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出AlCl3·6H2O,请简要说明该过程能够发生的原因____________________。
(6)用粉煤灰制取含铝化合物的主要意义是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是![]()
A.在蒸馏水中滴加浓![]() ,
,![]() 不变
不变
B.向![]() 溶液中滴加
溶液中滴加![]() 溶液,有沉淀和气体生成
溶液,有沉淀和气体生成
C.中和等体积等物质的量浓度的盐酸和醋酸,所消耗的氢氧化钠的物质的量相同
D.![]() 相等的
相等的![]() 溶液和
溶液和![]() 溶液,两溶液中水的电离程度相同
溶液,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
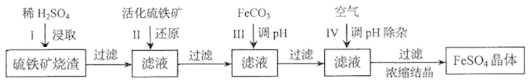
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_____________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择_________________(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是_______________。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=Fe+2Li2S,正极反应式是___________。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)H=-1648kJ/mol
C(s)+O2(g)=CO2(g)H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3___________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
![]()
A. A的结构简式是![]()
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明![]() 已完全转化为
已完全转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是短元素周期表的一部分,①~⑨是元素周期表中的部分元素。
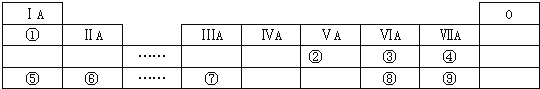
请回答下列问题:
(1)元素③④⑧的气态氢化物中最稳定的是__________(填化学式);
(2)元素⑤和⑦的最高价氧化物对应的水化物发生反应的离子方程式是_______________;
(3)元素⑥和⑨形成的化合物的电子式是________________;
(4)③、⑤、⑥形成的简单离子半径由大到小的顺序为_______________(写离子符号);
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂;已知液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式:___________________________;
(6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:
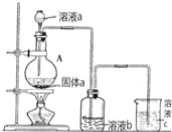
①浓溶液a和溶液b分别为_________、_______(写化学式);
②浓溶液a与黑色固体a反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,加水稀释
,加水稀释![]() 的氨水,下列判断正确的是
的氨水,下列判断正确的是
A.原氨水的浓度![]()
B.氨水的电离程度增大,溶液中所有离子的浓度均减小
C.溶液中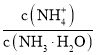 的增大
的增大
D.再加入![]() 的盐酸,混合液
的盐酸,混合液![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com