
【题目】将0.4mol N2气体和1mol H2气体在2L固定的容器内混合,在一定条件下发生反应:N2(g)+3H2(g)2NH3(g),若2min后测得NH3的浓度为0.2molL-1,
(1)2min时H2的转化率为______。
(2)2min时三种气体的总量为_____mol。
(3)相同温度下,若2min后该反应达平衡,则反应前后的气体压强比为___ 。
(4)下列措施能增大反应速率的是___(填字母)。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ:
化学键 | H-H | N-H | N≡N |
键能kJ/rmol | 436 | a | 945 |
试根据表中所列键能数据计算a的数值______。
【答案】60% 1 7:5 BD 391
【解析】
根据“三段式”计算出转化率,min时三种气体的总量,反应前后的气体压强比;根据化学反应速率的影响因素分析;根据焓变的计算公式进行计算。
(1)将0.4mol N2气体和1mol H2气体在2L固定的容器内混合,发生化学反应,2min后测得NH3的浓度为0.2molL-1,体积为2L,故氨气的物质的量为cV=0.2molL-1×2L=0.4mol,列出“三段式”,

(1)2min时H2的转化率为变化的物质的量浓度与起始物质的量浓度之比,由于体积相同,转化率为变化的物质的量与起始物质的量之比为![]() =60%;
=60%;
(2)2min时三种气体的总量为0.2mol+0.4mol+0.4mol=1mol;
(3)相同温度下,若2min后该反应达平衡,则反应前后的气体压强比为物质的量之比,为![]() =
=![]() =7:5;
=7:5;
(4) A.恒温恒容充入He气,气体的分压不变,故反应速率不变,故A不符合题意;
B.缩小体积,使压强增大,气体的浓度增大,反应速率加快,故B符合题意;
C.恒温恒压充入He气,气体的浓度减小,反应速率减慢,故C不符合题意;
D.使用催化剂,降低反应的活化能,反应速率加快,故D符合题意;
可以加快反应速率的有BD;
(4) 1molN2和3molH2反应生成2molNH3时放出热量93kJ,反应的焓变为反应物断裂化学键吸收的总能量-形成化学键吸收的总能量,436kJ/rmol×3+945kJ/rmol-6akJ/rmol=-93kJ/rmol,解得a=391kJ/rmol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化合物M是一种香料,可采用油脂与芳香烃(含苯环的烃)为主要原料,按下列路线合成:
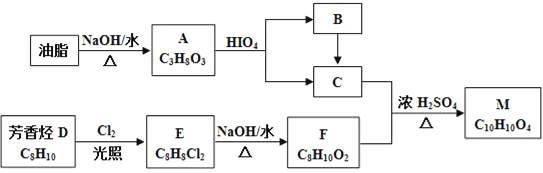
已知:①RX![]() ROH
ROH
②E分子中只有两种不同化学环境的H原子
③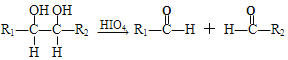
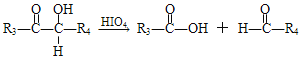
(R1、R2、R3与R4可能是氢、烃基或其他基团)
(1)A中官能团的名称是___,D→E的反应类型为___。
(2)E的结构简式为___。
(3)C+F→M的化学方程式____。
(4)下列化合物中属于F的同分异构体的是____。
a.![]()
b.![]()
c.![]()
d.CH2=CH﹣CH=CH﹣CH=CH﹣CH2COOH
(5)写出从Br﹣CH2CH2﹣Br→HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:aX(g)+bY(g)![]() cZ(g),达到平衡时测得X气体的浓度为3mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为1.4mol/L,则下列叙述不正确的是
cZ(g),达到平衡时测得X气体的浓度为3mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为1.4mol/L,则下列叙述不正确的是
A.a+b<cB.平衡向生成Z的方向移动
C.Z的体积分数降低D.Y的转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题。
(1)在25℃101kPa时,CO在1molO2中恰好完全燃烧,放出851.6kJ的热量。则CO燃烧的热化学方程式为___。
(2)同素异形体在一定条件下可以相互转化。已知:
白磷燃烧:P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
红磷燃烧:P(s)+![]() O2(g)=
O2(g)=![]() P4O10(s) △H=-738.5kJ/mol
P4O10(s) △H=-738.5kJ/mol
则相同状况下,能量状态较低的是___;白磷的稳定性比红磷___(填“高”或“低”),写出白磷转化为红磷的热化学方程式为___。
(3)已知CH4的燃烧热为akJ/mol,断裂1molO=O键时吸收热量bkJ,形成1molH—O键时放出热量ckJ,形成1molC=O键时放出热量dkJ,则C—H键断裂时吸收热量为___(用abcd表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:________。
(2)周期表中位于第8纵行的铁元素属于第________族。
(3)下列几种物质:①Ca(OH)2②H2O2③He④H2S ⑤MgCl2 ,只含有离子键的是(选填序号,下同)_________;只含有极性共价键的化合物是________;
(4)HClO的结构式______,I2的电子式______。
(5)下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④蔗糖溶液水⑤硫酸溶于水;未破坏化学键的是 _____;
(6)下列不能说明氯元素原子得电子能力比硫元素原子得电子能力强的是_____________
①HCl的溶解度比H2S的大 ②HCl的酸性比H2S的强 ③HCl的稳定性比H2S的强④Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑤HClO4的酸性比H2SO4的强 ⑥Cl2能与H2S反应生成S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛是制取航天航空工业钛合金的重要原料.用钛铁矿![]() 主要成分是钛酸亚铁
主要成分是钛酸亚铁![]() ,含少量
,含少量![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 作原料生产金属钛和绿矾
作原料生产金属钛和绿矾![]() 等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以
等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以![]() 无色
无色![]() 、
、![]() 紫色
紫色![]() 形式存在.
形式存在.
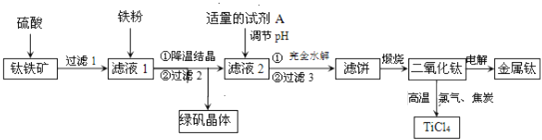
请回答下列问题:
![]() 硫酸与
硫酸与![]() 反应生成
反应生成![]() 的化学方程式是______.
的化学方程式是______.
![]() 滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
已知:氧化性:![]() 则加入铁粉的作用是______.
则加入铁粉的作用是______.
![]() 滤液2中加入适量的试剂A,可选用______
滤液2中加入适量的试剂A,可选用______![]() 填编号
填编号![]() .
.
![]() 稀
稀![]() 通入
通入![]() 鼓入空气
鼓入空气
![]() 已知
已知![]() ,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
![]() ,
,
![]() ,
,
![]()
反应![]() ______.
______.
![]() 用石墨作阳极、钛网作阴极、熔融
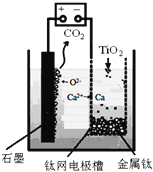
用石墨作阳极、钛网作阴极、熔融![]() 作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.
作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.
![]() 假如
假如![]() 中的铁元素占矿物中铁元素总量的
中的铁元素占矿物中铁元素总量的![]() ;某次生产中,向滤液1中加入纯铁粉为bkg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为
;某次生产中,向滤液1中加入纯铁粉为bkg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为![]() ,Ti元素的转化率为
,Ti元素的转化率为![]() ,其他损失忽略不计.按上述流程,得到
,其他损失忽略不计.按上述流程,得到![]() ______
______![]() 用数字和字母表示
用数字和字母表示![]() 已知:
已知:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.恒温恒容下,向容器中再充入少量的Ni(CO)4(g),达到新平衡时CO的百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
①![]()
![]() 和
和![]() 的混合气体中含有的原子个数为
的混合气体中含有的原子个数为![]()
②常温下,4g ![]() 含有
含有![]() 个
个![]() 共价键
共价键
③![]() 质量分数为
质量分数为![]() 的
的![]() ,加水至100mL,
,加水至100mL,![]() 的质量分数为
的质量分数为![]()
④标准状况下,![]() 四氯化碳含有的分子数为
四氯化碳含有的分子数为![]()
⑤![]() 时,
时,![]() 的
的![]() NaClO溶液中水电离出的
NaClO溶液中水电离出的![]() 的数目为
的数目为![]()
⑥![]() 溶液中含有
溶液中含有![]() 个
个![]()
⑦![]()
![]() 与水完全反应时转移电子数为
与水完全反应时转移电子数为![]()
A.③⑥⑦B.①②④C.①②⑤D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车安全气囊弹出时的反应为:![]() 下列说法正确的是( )
下列说法正确的是( )
A.自然界中氮、钠、硅元素均可以游离态形式存在
B.将反应后的固体溶于适量水,静置,通入![]() ,无现象
,无现象
C.微粒的半径:![]()
D.若反应中转移![]() 电子,则消耗
电子,则消耗![]() 的质量为
的质量为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com