
【题目】完成下列各题。
(1)在25℃101kPa时,CO在1molO2中恰好完全燃烧,放出851.6kJ的热量。则CO燃烧的热化学方程式为___。
(2)同素异形体在一定条件下可以相互转化。已知:
白磷燃烧:P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
红磷燃烧:P(s)+![]() O2(g)=
O2(g)=![]() P4O10(s) △H=-738.5kJ/mol
P4O10(s) △H=-738.5kJ/mol
则相同状况下,能量状态较低的是___;白磷的稳定性比红磷___(填“高”或“低”),写出白磷转化为红磷的热化学方程式为___。
(3)已知CH4的燃烧热为akJ/mol,断裂1molO=O键时吸收热量bkJ,形成1molH—O键时放出热量ckJ,形成1molC=O键时放出热量dkJ,则C—H键断裂时吸收热量为___(用abcd表示)。
【答案】2CO(g)+O2(g)=2CO2(g) △H=-851.6kJ/mol 红磷 低 P4(s)=4P(s)△H=-29.2kJ/mol ![]()
【解析】
(1)根据题意书写反应的热化学方程式;
(2)根据盖斯定律结合物质的能量越低,越稳定分析解答;
(3)根据CH4的燃烧热写出甲烷燃烧热的热化学方程式,再根据焓变△H =反应物总键能-生成物总键能计算。
(1)在25℃,101kPa时,CO在1molO2中恰好完全燃烧,放出851.6kJ的热量。则CO燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g) △H=-851.6kJ/mol,故答案为:2CO(g)+O2(g)=2CO2(g) △H=-851.6kJ/mol;
(2)①P4(白磷,s)+5O2(g)=P4O10(s)△H=-2983.2kJmol-1,②P(红磷,s)+5/4O2(g)=1/4P4O10(s)△H=-738.5kJmol-1,根据盖斯定律,①-②×4可得:P4(白磷,s)═4P(红磷,s) △H=-29.2kJmol-1,则相同状况下,白磷比红磷能量高;因为能量越低越稳定,所以红磷比白磷稳定,故答案为:红磷;低;P4(白磷,s)═4P(红磷,s)△H=-29.2kJmol-1;
(3)已知CH4的燃烧热为akJ/mol,则CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-akJ/mol,设1mol C-H键断裂时吸收热量为xkJ,焓变△H =反应物总键能-生成物总键能=(4x+2b)-(2d+4c)= -a,解得x=![]() ,故答案为:
,故答案为:![]() 。
。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者小于后者的是
①C(s)+ ![]() O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
②S(g)+O2(g) ===SO2(g);ΔH3 S(s)+O2(g) ===SO2(g);ΔH4
③CaO(s)+H2O(l) ===Ca(OH)2(s);ΔH5 CaCO3(s) ===CaO(s)+CO2(g);ΔH6
A.② B.①② C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为:2CH2=CH2+O2→2CH3CHO。下列说法错误的是( )
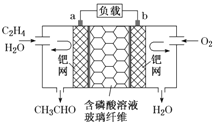
A.该电池可将化学能转化为电能B.正极区溶液的pH增大
C.负极反应式为CH2=CH2-2e-+H2O=CH3CHO+2H+D.每有0.1 mol O2反应,则溶液中迁移0.4 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T0时,在容积固定的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
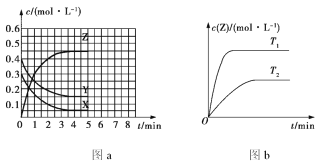
A. 发生反应时,各物质的反应速率大小关系为v(X)=v(Y)=2v(Z)
B. 图a中反应达到平衡时,Y的转化率为37.5%
C. T0时,该反应的平衡常数为33.3
D. 该反应正反应的反应热ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol![]() 和2mol
和2mol![]() ,开始时容器的体积均为VL,发生如下反应并达到平衡状态
,开始时容器的体积均为VL,发生如下反应并达到平衡状态![]() 提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)
提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)![]() aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是![]()
![]()
Ⅰ Ⅱ
Ⅱ Ⅲ
Ⅲ
A.物质Z的化学计量数 a= 2
B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4mol N2气体和1mol H2气体在2L固定的容器内混合,在一定条件下发生反应:N2(g)+3H2(g)2NH3(g),若2min后测得NH3的浓度为0.2molL-1,
(1)2min时H2的转化率为______。
(2)2min时三种气体的总量为_____mol。
(3)相同温度下,若2min后该反应达平衡,则反应前后的气体压强比为___ 。
(4)下列措施能增大反应速率的是___(填字母)。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ:
化学键 | H-H | N-H | N≡N |
键能kJ/rmol | 436 | a | 945 |
试根据表中所列键能数据计算a的数值______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t变化的曲线如图所示。下列说法正确的是( )
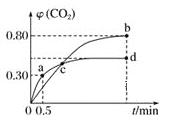
A.b点时,CO的转化率为20%
B.容器内的压强保持恒定,表明反应达到平衡状态
C.b点和d点的化学平衡常数:Kb>Kd
D.0→a点时,0到0.5 min反应速率v(CO)=0.3 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术]粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
(1)粉煤灰研磨的目的是_______________________。
(2)第1次过滤时滤渣的主要成分有__________、__________(填化学式,下同),第3次过滤时滤渣的成分是__________。
(3)在104℃用硫酸浸取时,铝的浸取率与时间关系如图1,适宜的浸取时间为__________h;铝的浸取率与![]() 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在![]() 相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。
相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。

(4)流程中循环使用的物质有__________。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出AlCl3·6H2O,请简要说明该过程能够发生的原因____________________。
(6)用粉煤灰制取含铝化合物的主要意义是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com