
【题目】温度为T0时,在容积固定的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
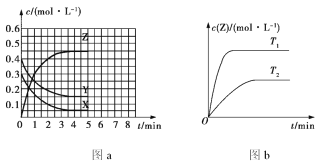
A. 发生反应时,各物质的反应速率大小关系为v(X)=v(Y)=2v(Z)
B. 图a中反应达到平衡时,Y的转化率为37.5%
C. T0时,该反应的平衡常数为33.3
D. 该反应正反应的反应热ΔH<0
【答案】C
【解析】
A. 同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比;
B. 根据反应的与起始的量计算转化率;
C. 平衡常数K等于生成物浓度的系数次幂与反应物浓度系数次幂之积的比值;
D. 根据图b可知T1>T2,结合温度高时Z的浓度大来分析。
A. 温度为T0时,X的物质的量浓度的变化量 = (0.30.05)mol/L = 0.25 mol/L;
Y的物质的量浓度的变化量 = (0.40.15) mol/L= 0.25 mol/L,
Z的物质的量浓度的变化(0.50) mol/L= 0.5 mol/L,该反应方程式为X(g)+Y(g)2Z(g),
所以发生反应时,各物质的反应速率大小关系为2v(X)=2v(Y)=v(Z),A项错误;
B. Y的转化率= ![]() = 62.5%,B项错误;
= 62.5%,B项错误;
C. 根据浓度的变化量可知,该反应方程式为X(g)+Y(g)2Z(g),所以反应的平衡常数K=![]() =33.3,C项正确;
=33.3,C项正确;
D. “先拐先平,数值大”,所以T1>T2,升高温度,Z的物质的量浓度增大,平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,所以该反应的正反应方向是吸热反应,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】锌碘液流电池具有高电容量、对环境友好、不易燃等优点,可作为汽车的动力电源。该电池采用无毒ZnI2水溶液作电解质溶液,放电时将电解液储罐中的电解质溶液泵入电池,其装置如右图所示。下列说法不正确的是

A.M是阳离子交换膜
B.充电时,多孔石墨接外电源的正极
C.充电时,储罐中的电解液导电性不断增强
D.放电时,每消耗1molI3-,有1 molZn2+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:A(g)+B(g)![]() C(s)+D(g) △H<0,正、逆反应速率变化如图所示(υ代表反应速率,t代表时间),则t1时改变平衡的一个条件是
C(s)+D(g) △H<0,正、逆反应速率变化如图所示(υ代表反应速率,t代表时间),则t1时改变平衡的一个条件是
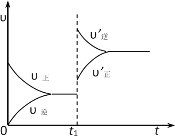
A.加入了正催化剂
B.加大了体系的压强
C.增加了体系的温度
D.加大了反应物的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:aX(g)+bY(g)![]() cZ(g),达到平衡时测得X气体的浓度为3mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为1.4mol/L,则下列叙述不正确的是
cZ(g),达到平衡时测得X气体的浓度为3mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为1.4mol/L,则下列叙述不正确的是
A.a+b<cB.平衡向生成Z的方向移动
C.Z的体积分数降低D.Y的转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列各题。
(1)25℃时,向AgCl的悬浊液中加入KI固体,有黄色沉淀生成。说明Ksp(AgCl)___Ksp(AgI)(填“<”、“>”或“=”下同)。
(2)已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-。若浓硫酸与氢氧化钠溶液发生中和反应生成1mol水,则ΔH的数值___57.3kJ·mol-;若稀盐酸与氨水发生中和反应生成1mol水,则ΔH的数值___57.3kJ·mol-1。
(3)在化学反应里只有活化分子才可能发生化学反应,使普通分子变成活化分子所需提供的最低限度的能量叫活化能。根据如图回答问题。
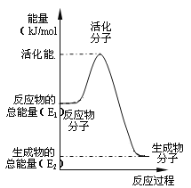
①图中所示反应是___(填“吸热”或“放热”)反应,该反应___(填“需要”或“不需要”)加热,该反应的△H=___(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为___。
O2(g)=H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题。
(1)在25℃101kPa时,CO在1molO2中恰好完全燃烧,放出851.6kJ的热量。则CO燃烧的热化学方程式为___。
(2)同素异形体在一定条件下可以相互转化。已知:
白磷燃烧:P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
红磷燃烧:P(s)+![]() O2(g)=
O2(g)=![]() P4O10(s) △H=-738.5kJ/mol
P4O10(s) △H=-738.5kJ/mol
则相同状况下,能量状态较低的是___;白磷的稳定性比红磷___(填“高”或“低”),写出白磷转化为红磷的热化学方程式为___。
(3)已知CH4的燃烧热为akJ/mol,断裂1molO=O键时吸收热量bkJ,形成1molH—O键时放出热量ckJ,形成1molC=O键时放出热量dkJ,则C—H键断裂时吸收热量为___(用abcd表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:________。
(2)周期表中位于第8纵行的铁元素属于第________族。
(3)下列几种物质:①Ca(OH)2②H2O2③He④H2S ⑤MgCl2 ,只含有离子键的是(选填序号,下同)_________;只含有极性共价键的化合物是________;
(4)HClO的结构式______,I2的电子式______。
(5)下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④蔗糖溶液水⑤硫酸溶于水;未破坏化学键的是 _____;
(6)下列不能说明氯元素原子得电子能力比硫元素原子得电子能力强的是_____________
①HCl的溶解度比H2S的大 ②HCl的酸性比H2S的强 ③HCl的稳定性比H2S的强④Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑤HClO4的酸性比H2SO4的强 ⑥Cl2能与H2S反应生成S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.恒温恒容下,向容器中再充入少量的Ni(CO)4(g),达到新平衡时CO的百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com