
【题目】反应:aX(g)+bY(g)![]() cZ(g),达到平衡时测得X气体的浓度为3mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为1.4mol/L,则下列叙述不正确的是
cZ(g),达到平衡时测得X气体的浓度为3mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为1.4mol/L,则下列叙述不正确的是
A.a+b<cB.平衡向生成Z的方向移动
C.Z的体积分数降低D.Y的转化率升高
科目:高中化学 来源: 题型:
【题目】在如图所示实验装置,X为直流电源的负极。甲池中充满H2SO4溶液,再分别插入铂电极。乙池中盛有AgNO3溶液,F、G为石墨电极。
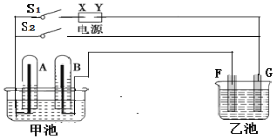
切断开关S2,闭合开关S1,通直流电一段时间
①甲池总反应方程式:____________;
②F电极反应方程式:___________;
③G电极的现象:______________;
④若F电极增重10.8g,B极上放出气体的体积(STP)是_______L;
⑤切断电源开关S1,闭合开关S2,此时甲池为__________(填原电池、电解池),A电极反应方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往一体积不变的密闭容器中充入H2和I2,发生反应H2(g) + I2(g)![]() 2HI(g);
2HI(g);![]() ,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )
,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )
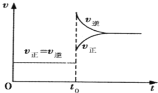
A.t0 时减小体积或升高体系温度
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度减小
D.容器内气体颜色变深,平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者小于后者的是
①C(s)+ ![]() O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
②S(g)+O2(g) ===SO2(g);ΔH3 S(s)+O2(g) ===SO2(g);ΔH4
③CaO(s)+H2O(l) ===Ca(OH)2(s);ΔH5 CaCO3(s) ===CaO(s)+CO2(g);ΔH6
A.② B.①② C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),发生H2(g)+CO2(g)CO(g)+H2O(g),其起始浓度如表所示。已知:平衡时甲中CO气体的浓度为0.006mol/L。下列判断不正确的是( )
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(H2) | 0.010 | 0.020 | 0.020 |
c(CO2) | 0.010 | 0.010 | 0.020 |
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲、乙、丙中CO2的转化率有如下关系:乙>甲=丙=60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.改变条件使乙中温度降低,新平衡中H2的浓度增大,则正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为:2CH2=CH2+O2→2CH3CHO。下列说法错误的是( )
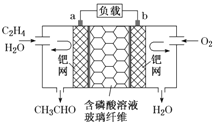
A.该电池可将化学能转化为电能B.正极区溶液的pH增大
C.负极反应式为CH2=CH2-2e-+H2O=CH3CHO+2H+D.每有0.1 mol O2反应,则溶液中迁移0.4 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T0时,在容积固定的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
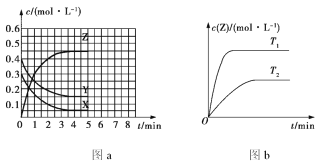
A. 发生反应时,各物质的反应速率大小关系为v(X)=v(Y)=2v(Z)
B. 图a中反应达到平衡时,Y的转化率为37.5%
C. T0时,该反应的平衡常数为33.3
D. 该反应正反应的反应热ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4mol N2气体和1mol H2气体在2L固定的容器内混合,在一定条件下发生反应:N2(g)+3H2(g)2NH3(g),若2min后测得NH3的浓度为0.2molL-1,
(1)2min时H2的转化率为______。
(2)2min时三种气体的总量为_____mol。
(3)相同温度下,若2min后该反应达平衡,则反应前后的气体压强比为___ 。
(4)下列措施能增大反应速率的是___(填字母)。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ:
化学键 | H-H | N-H | N≡N |
键能kJ/rmol | 436 | a | 945 |
试根据表中所列键能数据计算a的数值______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Cu、Mn三种元素的单质及化合物在生产、生活中有广泛应用.
![]()
![]() 是一种多功能材料,工业上常以
是一种多功能材料,工业上常以![]() 和尿素
和尿素![]() 、氧化剂等为原料制备.尿素分子中碳原子的杂化轨道类型为 ______ ,lmol尿素分子中含有的
、氧化剂等为原料制备.尿素分子中碳原子的杂化轨道类型为 ______ ,lmol尿素分子中含有的![]() 键数为 ______ .
键数为 ______ .
![]() 某学习小组拟以废旧于电池为原料制取锰,简易流程如下:
某学习小组拟以废旧于电池为原料制取锰,简易流程如下:
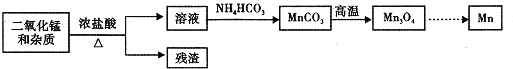
![]() 用浓盐酸溶解二氧化锰需保持通风,原因是 ______
用浓盐酸溶解二氧化锰需保持通风,原因是 ______ ![]() 用化学方程式表示
用化学方程式表示![]() .
.
![]() 写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 ______ .
写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 ______ .
![]() 基态铜原子的电子排布式为 ______ ,与Cu同周期且原子序数最小的第Ⅷ族元素,其基态原子核外有 ______ 个未成对电子.
基态铜原子的电子排布式为 ______ ,与Cu同周期且原子序数最小的第Ⅷ族元素,其基态原子核外有 ______ 个未成对电子.
![]() 图1是
图1是![]() 的晶胞结构,晶胞的边长为
的晶胞结构,晶胞的边长为![]() 则
则![]() 的密度为 ______
的密度为 ______ ![]() 用
用![]() 表示阿伏加德罗常数的值
表示阿伏加德罗常数的值![]() .
.
![]() 绿矾
绿矾![]() 是补血剂的原料,保存不当易变质.请设计实验检验绿矾是否完全变质 ______ .
是补血剂的原料,保存不当易变质.请设计实验检验绿矾是否完全变质 ______ .
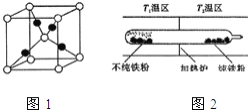
![]() 以羰基化合物为载体,提纯某纳米级活性铁粉
以羰基化合物为载体,提纯某纳米级活性铁粉![]() 含有一些不反应的杂质
含有一些不反应的杂质![]() ,反应装置如图
,反应装置如图![]() 已知:
已知:![]() ,常压下,
,常压下,![]()
![]() 的熔点约为
的熔点约为![]() ,沸点为
,沸点为![]() ,则
,则![]()
![]() 的晶体类型为 ______
的晶体类型为 ______ ![]() 请用平衡移动原理解释
请用平衡移动原理解释![]() 的原因 ______ .
的原因 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com