
【题目】锌碘液流电池具有高电容量、对环境友好、不易燃等优点,可作为汽车的动力电源。该电池采用无毒ZnI2水溶液作电解质溶液,放电时将电解液储罐中的电解质溶液泵入电池,其装置如右图所示。下列说法不正确的是

A.M是阳离子交换膜
B.充电时,多孔石墨接外电源的正极
C.充电时,储罐中的电解液导电性不断增强
D.放电时,每消耗1molI3-,有1 molZn2+生成
科目:高中化学 来源: 题型:
【题目】某小组研究第3周期元素性质的递变规律,设计了如下实验,并记录了实验现象:
实验步骤 | 实验现象 |
①将一小块钠放入滴有酚酞的冷水中 | A.有气体产生,溶液变成浅红色 |
②将用砂纸打磨过的镁条放入沸水中,再向其中滴加少量酚酞溶液 | B.浮在水面上,熔成小球,做不定向运动,随后消失,溶液变为红色 |
③将镁条放入稀盐酸中 | C.反应较快,产生无色气体 |
④将铝条放入稀盐酸中 | D.反应剧烈,迅速产生大量无色气体 |
(1)补齐实验步骤与实验现象之间的连线___________。

(2)由上述实验可知Na、Mg、Al三种元素原子失电子能力(金属性)依次_______(填“增强”或“减弱”)。从原子结构的角度解释原因____________。
(3)比较第3周期中硫与氯两种元素原子得电子能力(非金属性)的相对强弱。
①甲同学设计的下列方法可行的是_______。
A.比较气态氢化物的稳定性 B.比较盐酸与硫酸的酸性 C.比较单质与酸反应置换出氢气的难易程度
②乙同学设计将氯气通入硫化钠溶液中,观察是否有淡黄色沉淀生成。这一实验的设计思路是通过比较________,推知元素原子得电子能力的相对强弱。
(4)利用元素周期律可预测陌生元素及物质的性质,已知Rb与Na处于同一主族,下列说法正确的是_____。
A.失电子能力:Rb>Na B.碱性:NaOH>RbOH C.Rb比Na更容易与氧气发生反应 D.Rb不易与水反应放出H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )

A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性W比Z弱
C.Y的气态氢化物的稳定性较Z的弱
D.四种元素的单质中,Z的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示实验装置,X为直流电源的负极。甲池中充满H2SO4溶液,再分别插入铂电极。乙池中盛有AgNO3溶液,F、G为石墨电极。
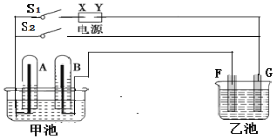
切断开关S2,闭合开关S1,通直流电一段时间
①甲池总反应方程式:____________;
②F电极反应方程式:___________;
③G电极的现象:______________;
④若F电极增重10.8g,B极上放出气体的体积(STP)是_______L;
⑤切断电源开关S1,闭合开关S2,此时甲池为__________(填原电池、电解池),A电极反应方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下HF的电离常数Ka=3.3×10-4 ,CaF2的溶度积常数Ksp=1.46×10-10。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是
A. 该温度下,0.31 mol·L-1的HF溶液的pH=2
B. 升高温度或增大浓度,HF的电离平衡常数都将增大
C. 两溶液混合不会产生沉淀
D. 向饱和的CaF2溶液中加入少量CaCl2固体后,溶度积常数Ksp一定比之前减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__min(填0~1、1~2、2~3、3~4、4~5),原因是___。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是___。
A.蒸馏水 B.KCl溶液C.KNO3溶液D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是___。
②该反应达到平衡状态的标志是___。
A.Y的体积分数在混合气体中保持不变
B.2v(X)=3v(Z)
C.容器内气体压强保持不变
D.X、Y、Z三种气体的浓度之比为3:1:2
E.生成1molY的同时消耗2molZ
F.容器内气体的平均相对分子质量保持不变
③2min内Y的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往一体积不变的密闭容器中充入H2和I2,发生反应H2(g) + I2(g)![]() 2HI(g);
2HI(g);![]() ,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )
,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )
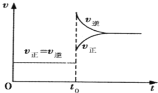
A.t0 时减小体积或升高体系温度
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度减小
D.容器内气体颜色变深,平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T0时,在容积固定的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平),4 min 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
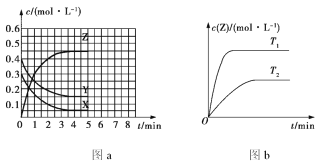
A. 发生反应时,各物质的反应速率大小关系为v(X)=v(Y)=2v(Z)
B. 图a中反应达到平衡时,Y的转化率为37.5%
C. T0时,该反应的平衡常数为33.3
D. 该反应正反应的反应热ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com