
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
(1)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯����400mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ)��
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 464 | 576 | 620 |
����һʱ��η�Ӧ�������__min(��0��1��1��2��2��3��3��4��4��5)��ԭ����___��
����3��4����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����___(����Һ�������)��
(2)��һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʣ�����Ϊ�����е���___��
A.����ˮ B.KCl��ҺC.KNO3��ҺD.CuSO4��Һ
(3)ij�¶�����4L�ܱ������У�X��Y��Z������̬���ʵ����ʵ�����ʱ��仯������ͼ��

�ٸ÷�Ӧ�Ļ�ѧ����ʽ��___��
�ڸ÷�Ӧ�ﵽƽ��״̬�ı�־��___��
A.Y����������ڻ�������б��ֲ���
B.2v(X)=3v(Z)
C.����������ѹǿ���ֲ���
D.X��Y��Z���������Ũ��֮��Ϊ3:1:2
E.����1molY��ͬʱ����2molZ
F.�����������ƽ����Է����������ֲ���
��2min��Y��ת����Ϊ___��
���𰸡�2-3 �÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ���Ӧ����Խ�� 0.025mol��L-1��min-1 CD 3X(g)+Y(g)2Z(g) ACF 10%
��������
(1)����ͬͨ�����£���Ӧ����Խ����ͬʱ�����ռ�������Խ�ࣻ�ɱ������ݿ�֪����Ӧ��������ʱ�����23min��ԭ���ǣ��÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ���Ӧ����Խ��
��34����ʱ��Σ��ռ����������=(576464)mL=112mL��n(H2)=![]() =0.005mol������������HCl��ϵʽ�����ĵ�n(HCl)=2n(H2)=2��0.005mol=0.01mol����v(HCl)=
=0.005mol������������HCl��ϵʽ�����ĵ�n(HCl)=2n(H2)=2��0.005mol=0.01mol����v(HCl)=![]() =0.025 mol/(Lmin)��
=0.025 mol/(Lmin)��
(2)A����������ˮ��������Ũ�ȼ�С����Ӧ���ʽ��ͣ���A���У�
B������KCl��Һ��������Ũ�Ƚ��ͣ���Ӧ���ʽ��ͣ���B���У�
C������KNO3��Һ���൱�ں������ᣬ�����Zn��Ӧ����NO��������������C�����У�
D������CuSO4��Һ��Zn��ͭ���ӷ�Ӧ����Cu��Zn��Cu��ϡ���ṹ��ԭ��ض��ӿ췴Ӧ���ʣ���D�����У�
��ѡCD��
(3)�ٸ���ͼ֪�����ŷ�Ӧ���У�X��Y�����ʵ������ٶ�Z�����ʵ������ӣ���X��Y�Ƿ�Ӧ���Z���������Ӧ�ﵽƽ��ʱ����n(X)=(1.00.4)mol=0.6mol����n(Y)=(1.00.8)mol=0.2mol����n(Z)=(0.50.1)mol=0.4mol��ͬһ���淴Ӧ��ͬһ��ʱ���ڲμӷ�Ӧ�ĸ����ʵ����ʵ����仯��֮�ȵ��������֮�ȣ�X��Y��Z�ļ�����֮��=0.6mol��0.2mol��0.4mol=3:1:2����÷�Ӧ����ʽΪ3X+Y2Z��
��A��Y����������ڻ�������б��ֲ��䣬˵�������ʵ������䣬��Ӧ�ﵽƽ��״̬����A�Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
B��2v(X)=3v(Z)��![]() �������Ӧ���ʶ���ָͬһ����ķ�Ӧ���ʣ���÷�Ӧ��һ���ﵽƽ��״̬����B���Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
�������Ӧ���ʶ���ָͬһ����ķ�Ӧ���ʣ���÷�Ӧ��һ���ﵽƽ��״̬����B���Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
C����Ӧǰ������ѹǿ��С��������������ѹǿ���ֲ���ʱ�������ʵ����ʵ������䣬��Ӧ�ﵽƽ��״̬����C�Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
D����Ӧ�ﵽƽ��״̬ʱ����ϵ�и���ֵ�Ũ�Ȳ��ٷ����仯����X��Y��Z���������Ũ��֮��Ϊ3:1:2������˵����Ӧ�ﵽƽ��״̬����D���Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
E������1mol Y��ͬʱ����2molZ������ָͬһ����ķ�Ӧ���ʣ�������Ϊ�жϴﵽƽ��״̬�����ݣ���E���Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
F��ƽ����Է�����������ֵ����ƽ��Ħ������������M=![]() ��������������ѭ�����غ㣬�������������䣬��Ӧǰ����������ʵ����ı䣬��ƽ����Է�������(ƽ��Ħ������)���ֲ���ʱ����Ӧ�ﵽƽ��״̬����F�Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
��������������ѭ�����غ㣬�������������䣬��Ӧǰ����������ʵ����ı䣬��ƽ����Է�������(ƽ��Ħ������)���ֲ���ʱ����Ӧ�ﵽƽ��״̬����F�Ƿ�Ӧ�ﵽƽ��״̬�ı�־��
��ѡACF��
��Y��ת����=![]() ��100%=
��100%=![]() ��100%=10%��
��100%=10%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij�¶�(t ��)ʱ��ˮ��Kw��1��10��12������¶�____��������������������������25 �棬��������_________________________________________________________��
��2�����¶��£�c(H��)��1��10��7 mol/L����Һ��_____���������ԡ����Ի�����������������Һ��ֻ����NaOH���ʣ�����H2O���������c(OH��)��________ mol/L��
��3��ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ��______������������ ��������������������ͬ ���ƶ�����������ˮ�м���������NaCl���壬ˮ�ĵ���ƽ��________�ƶ���
��4��25 ��ʱ��pH��4��������ˮ�ĵ���̶�________��������������С����������������pH��10��Ba(OH)2��Һ��ˮ�ĵ���̶ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е������Һ�й�������ȷ����
A������������ϡ�������ʱ��HF��Ka����ˮ��KW����
B����Mg(OH)2��������Һ�м���NH4Cl���壬c��Mg2������c��OH����Ũ�Ⱦ�����
C��0��1mol��LNaHCO3��Һ�У�c��Na������c��![]() ����c��
����c��![]() ����c��H2CO3��
����c��H2CO3��
D��0��1mol��LNa2SO3��Һ�У���������NaOH���壬c��![]() ����c��Na����������
����c��Na����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��Һ����ؾ��иߵ��������Ի����Ѻá�����ȼ���ŵ㣬����Ϊ�����Ķ�����Դ���õ�ز�����ZnI2ˮ��Һ���������Һ���ŵ�ʱ�����Һ�����еĵ������Һ�����أ���װ������ͼ��ʾ������˵������ȷ����

A.M�������ӽ���Ĥ
B.���ʱ�����ʯī�����Դ������
C.���ʱ�������еĵ��Һ�����Բ�����ǿ
D.�ŵ�ʱ��ÿ����1molI3������1 molZn2+����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г���A-F6��Ԫ�������ڱ��ж����ڵ�λ�á�
C | D | ||||||
A | B | E | F |
��ش��������⣺
(1)CԪ�������ڱ��е�λ��___��CԪ�ص�һ�����������������壬��������ĵ���ʽΪ��___��
(2)A��B������������Ӧ��ˮ������Խ�ǿ����___��(�ѧʽ)
(3)D��ͬ����һ����Ԫ�ص���̬�⻯��ķе�ϸߵ���___(�ѧʽ)��ԭ����___��
(4)Ԫ��E��Ԫ��F��ȣ��ǽ����Խ�ǿ����___(��Ԫ�ط�����д)�����б�������֤����һ��ʵ����___(�ɶ�ѡ)��
��F���⻯���E���⻯���ȶ�
�ڳ�����F�ĵ��ʺ�E�ĵ���״̬��ͬ
��һ��������F��E�ĵ��ʶ���������������Һ��Ӧ
��F���������ˮ��������Ա�E���������ˮ���������ǿ
��F����E�����⻯��ˮ��Һ���û�����
(5)Ԫ��E��һ��������ͨ���Ȼ�����Һ������ͨ�����ᱵ��Һȴ�������ɫ������д��������������ͨ�����ᱵ��Һ�����ӷ���ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������M��һ�����ϣ��ɲ�����֬�뷼������������������Ϊ��Ҫԭ�ϣ�������·�ߺϳɣ�
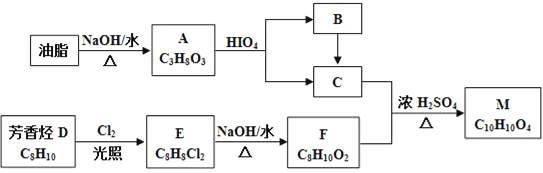
��֪����RX![]() ROH
ROH
��E������ֻ�����ֲ�ͬ��ѧ������Hԭ��
��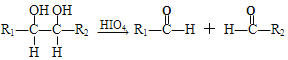
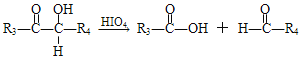
��R1��R2��R3��R4�������⡢�������������ţ�
��1��A�й����ŵ�������___��D��E�ķ�Ӧ����Ϊ___��
��2��E�Ľṹ��ʽΪ___��
��3��C+F��M�Ļ�ѧ����ʽ____��
��4�����л�����������F��ͬ���칹�����____��
a��![]()
b��![]()
c��![]()
d��CH2=CH��CH=CH��CH=CH��CH2COOH
��5��д����Br��CH2CH2��Br��HCOOCH2CH2OOCH�ĺϳ�·�ߣ����Լ���ѡ���ϳ�·�߲������е���д��ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪CO2��3H2![]() CH3OH��H2O����120��ʱ22gCO2����������Ӧ,�䷴Ӧ���̵������仯��ͼ��ʾ(��λΪkJ��mol-1)��
CH3OH��H2O����120��ʱ22gCO2����������Ӧ,�䷴Ӧ���̵������仯��ͼ��ʾ(��λΪkJ��mol-1)��
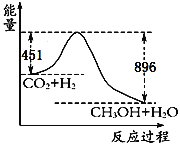
�ٸ÷�Ӧ���Ȼ�ѧ����ʽΪ____________________��
�ڸ÷�Ӧƽ�ⳣ��K�ı���ʽΪ_______________________��
�������Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2��Ӧ�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ���ӷ�Ӧ��ʼ���ﵽ��ѧƽ�⣬v(H2)=______mol/��L��min�������д�ʩ����ʹ![]() �������__________������ĸ����
�������__________������ĸ����
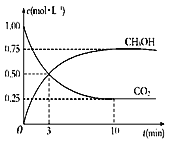
A.�����¶� B.������� C.��H2O(g)����ϵ�з���
D.�ٳ���3 mol H2 E.����He(g)��ʹ��ϵ��ѹǿ����
(2)��ҵ�ϳ���������Ĥ��ⷨ��������Ũ����ȩ��ˮ����ԭ����ʹ��ȩ�ֱ�����������������Ӧ�����Ҵ������ᣬ�ܷ�ӦʽΪ2CH3CHO+H2O=CH3CH2OH+CH3COOH��ʵ���Ұ���ͼ��ʾװ����ģ����ȩ��ˮ�Ĵ�������һ��Ũ�ȵ���ȩ��Na2SO4��ҺΪ�������Һ����
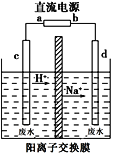
�����Լ״�����ȼ�ϵ��Ϊֱ����Դ����ȼ�ϵ����b��Ӧͨ��____(�ѧʽ)��
�ڵ����������ĵ缫��ӦʽΪ_______________________________��
����ʵ�ʹ��մ����У���������ȩ��ȥ���ʿɴ�60%�������������ֱ�ע����ȩ����Ϊ3g/L�ķ�ˮ1 m3���ɵõ��Ҵ�________kg������������С�������λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��A(g)��B(g)![]() C(s)+D(g) ��H��0�������淴Ӧ���ʱ仯��ͼ��ʾ����������Ӧ���ʣ�t����ʱ�䣩����t1ʱ�ı�ƽ���һ��������
C(s)+D(g) ��H��0�������淴Ӧ���ʱ仯��ͼ��ʾ����������Ӧ���ʣ�t����ʱ�䣩����t1ʱ�ı�ƽ���һ��������
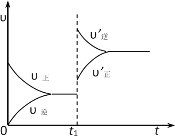
A.������������
B.�Ӵ�����ϵ��ѹǿ
C.��������ϵ���¶�
D.�Ӵ��˷�Ӧ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д���пհף�
(1)д����ʾ����8�����ӡ�10�����ӵ�ԭ�ӵĻ�ѧ���ţ�________��
(2)���ڱ���λ�ڵ�8���е���Ԫ�����ڵ�________�塣
(3)���м������ʣ���Ca(OH)2��H2O2��He��H2S ��MgCl2 ,ֻ�������Ӽ�����(ѡ����ţ���ͬ)_________��ֻ���м��Թ��ۼ��Ļ�������________��
(4)HClO�Ľṹʽ______��I2�ĵ���ʽ______��
(5)���б仯�У��ٸɱ���������������ۻ�����KHSO4���ڣ���������Һˮ����������ˮ��δ�ƻ���ѧ������ _____��
(6)���в���˵����Ԫ��ԭ�ӵõ�����������Ԫ��ԭ�ӵõ�������ǿ����_____________
��HCl���ܽ�ȱ�H2S�Ĵ� ��HCl�����Ա�H2S��ǿ ��HCl���ȶ��Ա�H2S��ǿ��Cl2������Ӧ����FeCl3����S������Ӧ����FeS ��HClO4�����Ա�H2SO4��ǿ ��Cl2����H2S��Ӧ����S
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com