
����Ŀ��(1)��֪CO2��3H2![]() CH3OH��H2O����120��ʱ22gCO2����������Ӧ,�䷴Ӧ���̵������仯��ͼ��ʾ(��λΪkJ��mol-1)��
CH3OH��H2O����120��ʱ22gCO2����������Ӧ,�䷴Ӧ���̵������仯��ͼ��ʾ(��λΪkJ��mol-1)��
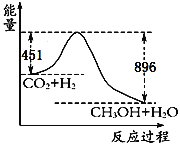
�ٸ÷�Ӧ���Ȼ�ѧ����ʽΪ____________________��
�ڸ÷�Ӧƽ�ⳣ��K�ı���ʽΪ_______________________��
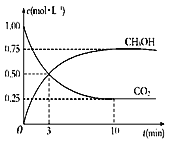
�������Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2��Ӧ�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ���ӷ�Ӧ��ʼ���ﵽ��ѧƽ�⣬v(H2)=______mol/��L��min�������д�ʩ����ʹ![]() �������__________������ĸ����
�������__________������ĸ����
A.�����¶� B.������� C.��H2O(g)����ϵ�з���
D.�ٳ���3 mol H2 E.����He(g)��ʹ��ϵ��ѹǿ����
(2)��ҵ�ϳ���������Ĥ��ⷨ��������Ũ����ȩ��ˮ����ԭ����ʹ��ȩ�ֱ�����������������Ӧ�����Ҵ������ᣬ�ܷ�ӦʽΪ2CH3CHO+H2O=CH3CH2OH+CH3COOH��ʵ���Ұ���ͼ��ʾװ����ģ����ȩ��ˮ�Ĵ�������һ��Ũ�ȵ���ȩ��Na2SO4��ҺΪ�������Һ����
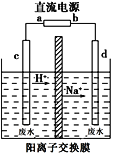
�����Լ״�����ȼ�ϵ��Ϊֱ����Դ����ȼ�ϵ����b��Ӧͨ��____(�ѧʽ)��
�ڵ����������ĵ缫��ӦʽΪ_______________________________��
����ʵ�ʹ��մ����У���������ȩ��ȥ���ʿɴ�60%�������������ֱ�ע����ȩ����Ϊ3g/L�ķ�ˮ1 m3���ɵõ��Ҵ�________kg������������С�������λ����
���𰸡�CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)����H=-890 kJ/mol K=
CH3OH(g)��H2O(g)����H=-890 kJ/mol K= ![]() 0.225 C��D CH3OH CH3CHO-2e-+H2O=CH3COOH+2H+ 1.88
0.225 C��D CH3OH CH3CHO-2e-+H2O=CH3COOH+2H+ 1.88
��������
(1)����ͼ1��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ����22gCO2����������Ӧ���ų�����Ϊ896kJ-451kJ=445kJ���ݴ���д�Ȼ�ѧ����ʽ��
�ڻ�ѧƽ�ⳣ������ָ��һ���¶��£��ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ���ݴ���д��
����ͼ2��֪���״���Ũ�ȱ仯��Ϊ0.75mol/L������v=![]() ����v(CH3OH)������������֮�ȵ��ڻ�ѧ������֮�ȼ���v(H2)��ʹ
����v(CH3OH)������������֮�ȵ��ڻ�ѧ������֮�ȼ���v(H2)��ʹ![]() ���ı�����ʹƽ��������Ӧ�ƶ�����ֻ���������̼��Ũ�Ȼ�ʹ�ñ�ֵ��С��
���ı�����ʹƽ��������Ӧ�ƶ�����ֻ���������̼��Ũ�Ȼ�ʹ�ñ�ֵ��С��
(2)�����ӵ�����������ԭ��ظ�����ȼ�ϵ�ظ�����Ͷ��ȼ�ϣ�ȼ��ʧ���ӷ���������Ӧ��
����������ȩʧ���ӷ���������Ӧ�������
���ȸ��ݷ�ˮ����������ȩ��ȥ���ʼ���ȥ����ȩ���������ٸ�����ȩ���Ҵ��Ĺ�ϵʽ���������Ҵ���������
(1)����ͼ1��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ����22gCO2����������Ӧ���ų�����Ϊ896kJ-451kJ=445kJ������1molCO2����������Ӧ���ų�����Ϊ445kJ��2=890kJ����Ӧ���Ȼ�ѧ����ʽΪCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����H=-890kJ/mol��
CH3OH(g)+H2O(g)����H=-890kJ/mol��
�ڿ��淴ӦCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)�Ļ�ѧƽ�ⳣ��k=
CH3OH(g)+H2O(g)�Ļ�ѧƽ�ⳣ��k=![]() ��
��
����ͼ2��֪��10min��ƽ��ʱ�״���Ũ�ȱ仯��Ϊ0.75mol/L������v(CH3OH)=![]() =0.075mol/(Lmin)��������ͬһ��ѧ��Ӧ�У��ò�ͬ���ʱ�ʾ�ķ�Ӧ���ʣ�����֮�ȵ�����Ӧ���ʵĻ�ѧ������֮�ȣ�����v(H2)=3v(CH3OH)=3��0.075mol/(Lmin)=0.225mol/(Lmin)��
=0.075mol/(Lmin)��������ͬһ��ѧ��Ӧ�У��ò�ͬ���ʱ�ʾ�ķ�Ӧ���ʣ�����֮�ȵ�����Ӧ���ʵĻ�ѧ������֮�ȣ�����v(H2)=3v(CH3OH)=3��0.075mol/(Lmin)=0.225mol/(Lmin)��
ʹ![]() ���ı�����ʹƽ��������Ӧ�ƶ�����ֻ���������̼��Ũ�Ȼ�ʹ�ñ�ֵ��С��
���ı�����ʹƽ��������Ӧ�ƶ�����ֻ���������̼��Ũ�Ȼ�ʹ�ñ�ֵ��С��
A.�����¶ȣ���ѧƽ�������ȵ��淴Ӧ�ƶ�������![]() ��С��A����
����A����
B.�����������ѧƽ�ⲻ�ƶ���![]() ���䣬B����
���䣬B����
C.��H2O(g)����ϵ�з��룬����С���������Ũ�ȣ���ѧƽ��������Ӧ�ƶ���![]() ����C��ȷ��
����C��ȷ��
D.�ٳ���1mol CO2��3mol H2����ЧΪ����ѹǿ����ѧƽ������Ӧ�ƶ���ƽ��ʱ![]() ����D��ȷ��
����D��ȷ��
E.����He(g)����Ӧ������Ũ�Ȳ��䣬�仯���ƶ���![]() ���䣬E����
���䣬E����
�ʺ���ѡ����CD��
(2)�����ӵ�����������ԭ��ظ������ڸ����ϣ�ȼ��CH3OHʧ���ӷ���������Ӧ����ȼ�ϵ����ȼ���Ǽ״�������b�缫��Ͷ�ŵ���CH3OH��
�ڵ������У�������ʧ���ӷ���������Ӧ�������ϵõ��ӷ�����ԭ��Ӧ��������������ȩ�����������ӷŵ磬���Գ�������������ʧȥ�����⣬��ȩʧ���ӷ���������Ӧ���缫��ӦʽΪCH3CHO-2e-+H2O=CH3COOH+2H+��
���������Ҵ���������x����ˮ����ȩ������Ϊ1m3��1000L/m3��3g/L=3000g=3kg����ȩ��ȥ����Ϊ60%����Ӧ����ȩΪ1.8kg�����ݷ���ʽCH3CHO+2e-+2H2O=CH3CH2OH+2OH-��֪44kg��ȩ��Ӧ�����46kg�Ҵ�����1.8kg��ȩ��Ӧ�������Ҵ�������Ϊx=![]() ��1.8kg=1.88kg��
��1.8kg=1.88kg��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ����������ĵ��볣�����£�
����Ļ�ѧʽ | CH3COOH | HCN | H2S |
���볣��(25 ��) | 1.8��10��5 | 4.9��10��10 | K1��1.3��10��7 K2��7.1��10��15 |
25 ��ʱ������˵����ȷ����
A.�����ʵ���Ũ�ȵĸ���Һ��pH��ϵΪ��pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN��Һ��b mol/L NaOH��Һ�������ϣ�������Һ��c(Na��)>c(CN��)����aһ������b
C.NaHS��Na2S�Ļ����Һ�У�һ������c(Na��)��c(H��)��c(OH��)��c(HS��)��2c(S2��)
D.ijŨ�ȵ�HCN��Һ��pH��d��������c(OH��)��10��d mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶���HF�ĵ��볣��Ka=3.3��10-4 ��CaF2���ܶȻ�����Ksp=1.46��10-10���ڸ��¶���ȡŨ��Ϊ0.31 mol��L-1��HF��Ũ��Ϊ0.002 mol��L-1��CaCl2��Һ�������ϡ�����˵����ȷ����
A. ���¶��£�0.31 mol��L-1��HF��Һ��pH=2
B. �����¶Ȼ�����Ũ�ȣ�HF�ĵ���ƽ�ⳣ����������
C. ����Һ��ϲ����������
D. �͵�CaF2��Һ�м�������CaCl2������ܶȻ�����Kspһ����֮ǰ��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
(1)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯����400mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ)��
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 464 | 576 | 620 |
����һʱ��η�Ӧ�������__min(��0��1��1��2��2��3��3��4��4��5)��ԭ����___��
����3��4����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����___(����Һ�������)��
(2)��һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʣ�����Ϊ�����е���___��
A.����ˮ B.KCl��ҺC.KNO3��ҺD.CuSO4��Һ
(3)ij�¶�����4L�ܱ������У�X��Y��Z������̬���ʵ����ʵ�����ʱ��仯������ͼ��

�ٸ÷�Ӧ�Ļ�ѧ����ʽ��___��
�ڸ÷�Ӧ�ﵽƽ��״̬�ı�־��___��
A.Y����������ڻ�������б��ֲ���
B.2v(X)=3v(Z)
C.����������ѹǿ���ֲ���
D.X��Y��Z���������Ũ��֮��Ϊ3:1:2
E.����1molY��ͬʱ����2molZ
F.�����������ƽ����Է����������ֲ���
��2min��Y��ת����Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���Ľṹ��ʽ��ͼ��ʾ�������й�˵����ȷ���ǣ� ��

A.���л���Ļ�ѧʽΪC11H12OCl2
B.��ͬһƽ���ϵ�̼ԭ�������Ϊ10��
C.��NaOH����Һ�ڼ�����������ȥ��ԭ��
D.��ͭ�������ͼ����������ܱ�O2������ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������ܱ������г���H2��I2��������ӦH2(g) + I2(g)![]() 2HI(g)��
2HI(g)��![]() �����ﵽƽ���t0 ʱ�����ֻ�����������ʵ���������ı�ijһ��Ӧ������ʹ������ѹǿ������ͼ��ʾ��������˵����ȷ���ǣ� ��
�����ﵽƽ���t0 ʱ�����ֻ�����������ʵ���������ı�ijһ��Ӧ������ʹ������ѹǿ������ͼ��ʾ��������˵����ȷ���ǣ� ��
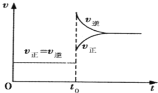
A.t0 ʱ��С�����������ϵ�¶�
B.ƽ�ⲻ�ƶ�����������ܶ�����
C.H2ת��������HIƽ��Ũ�ȼ�С
D.������������ɫ���ƽ����Է�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2L�����ܱ������г���1.0molA��1.0molB��������ӦA(g)+B(g)![]() C(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
C(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
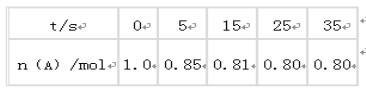
A����Ӧ��ǰ5s��ƽ������v(A)= 0. 17mol/(L��s)
B�����������������䣬�����¶ȣ�ƽ��ʱc(A)=0.41mol/L����Ӧ�ġ�H��0
C����ͬ�¶��£���ʼʱ�������г���2.0molC���ﵽƽ��ʱ��C��ת���ʴ���80%
D����ͬ�¶��£���ʼʱ�������г���0.20 molA��0.20 molB��1.0molC����Ӧ�ﵽƽ��ǰv(��)��v(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶����ڼס��ҡ������������ܱ������У�Ͷ��H2(g)��CO2(g)������H2(g)+CO2(g)CO(g)+H2O(g)������ʼŨ�������ʾ����֪��ƽ��ʱ����CO�����Ũ��Ϊ0.006mol/L�������жϲ���ȷ���ǣ� ��
��ʼŨ��(mol/L) | �� | �� | �� |
c(H2) | 0.010 | 0.020 | 0.020 |
c(CO2) | 0.010 | 0.010 | 0.020 |
A.��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
B.ƽ��ʱ���ס��ҡ�����CO2��ת���������¹�ϵ����>��=��=60%
C.ƽ��ʱ������c(CO2)�Ǽ��е�2������0.012mol/L
D.�ı�����ʹ�����¶Ƚ��ͣ���ƽ����H2��Ũ������������Ӧ����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������н��з�Ӧ��X2(g)+Y2(g)![]() 2Z(g)����X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����һ�������£�����Ӧ�ﵽƽ��״̬ʱ������˵����ȷ����
2Z(g)����X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����һ�������£�����Ӧ�ﵽƽ��״̬ʱ������˵����ȷ����
A��Z��Ũ�ȿ���Ϊ0.3mol/L
B��ƽ��ʱX2��Y2��ת�������
C��ƽ��ʱ��Y2��Z����������֮��Ϊ2:1
D����ƽ����ٸı���������������¶ȣ���Ӧ��ƽ�ⳣ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com