
【题目】某温度下,向2L恒容密闭容器中充入1.0molA和1.0molB,发生反应A(g)+B(g)![]() C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
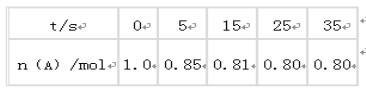
A.反应在前5s的平均速率v(A)= 0. 17mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则反应的△H>0
C.相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 molA、0.20 molB和1.0molC,反应达到平衡前v(正)<v(逆)
【答案】D
【解析】
试题分析:反应在前5s的平均速率v(A)= ![]() 0.015mol/(Ls),故A错误;保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则A的浓度增大,平衡逆向移动,则反应的△H<0,故B错误;相同温度下,起始时向容器中充入1.0molC,根据等效平衡原理,达到平衡时A的物质的量为0.8mol, C的转化率为80%,若起始时向容器中充入2.0molC,相当于加压,平衡正向移动,所以C的转化率小于80%,故C错误;根据表格中的数据,起始时向容器中充入0.80molA、0.80molB和0.2molC,为平衡状态,v(正)=v(逆),向容器中充入0.20molA、0.20molB和1.0molC,反应逆向进行,故v(正)<v(逆),故D正确。
0.015mol/(Ls),故A错误;保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则A的浓度增大,平衡逆向移动,则反应的△H<0,故B错误;相同温度下,起始时向容器中充入1.0molC,根据等效平衡原理,达到平衡时A的物质的量为0.8mol, C的转化率为80%,若起始时向容器中充入2.0molC,相当于加压,平衡正向移动,所以C的转化率小于80%,故C错误;根据表格中的数据,起始时向容器中充入0.80molA、0.80molB和0.2molC,为平衡状态,v(正)=v(逆),向容器中充入0.20molA、0.20molB和1.0molC,反应逆向进行,故v(正)<v(逆),故D正确。


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. SO2具有氧化性,可用于漂泊纸浆
B. NH4HCO3 受热易分解,可用作氮肥
C. 明矾溶于水产生的SO42- 有氧化性,可用于净水
D. 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 A、B、C、D、E、F 的原子序数依次增大,A 原子核外最外 层电子数是其电子层数的 2 倍,A、B 的核电荷数之比为 3:4。C 与 D 均为金属元素,5.8 g D 的氢氧化物恰好能与 100 mL 2 mol·L-1 盐酸完全反应,D 原子核中质子数和中子数相等。E 与F 相邻,F-的最外层为 8 电子结构。根据上述条件,用化.学.用.语.回答:
(1)D 在周期表中的位置____;
(2)B、C 易形成淡黄色化合物,其电子式为____,该物质含有的化学键 类型为_____;
(3)用电子式表示 DF2 的形成过程____;
(4)元素 E、F 中非金属性较强的是____,请用一个置换反应证明____(写化学反应方程式);
(5)原子半径:C____E;熔点:DB____CF(填“>”“<”或“=”);
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为____;含 A元素的化合物在是自然界种类最多的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中大量存在五种离子:NO3-、SO42-、 Fe3+、H+、X,其物质的量之比为:n(NO3-)︰n(SO42-)︰n(Fe3+)︰n(H+)︰n(X)=2︰3︰1︰3︰1,则X可能为
A. Fe2+ B. Mg2+ C. Cl- D. Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气污染是造成雾霾天气的重要原因之一,解决这个问题除了限制汽车出行外,更重要的是研发催化汽车尾气的转化技术,该技术中催化剂及载体的选择和改良是关键。某稀土催化剂转化汽车尾气示意图如图:

(1)下列有关说法正确的是__________
a.C5H8与CH3CH=CH2一样,分子中碳原子都采用的是sp3杂化
b.H2O、CO2、N2都是非极性分子
c.每个CO2分子中,含有2个π键和2个σ键
d.CO的一种等电子体为NO+,它的电子式为[:NO:]+
(2)CO与Fe可生成羰基镍[Fe(CO)5],已知其中铁为0价,铁原子在基态核外电子排布式为___________;[Fe(CO)5]的配位原子是________,理由是________。
(3)C、N、O三种元素的第一电离能由大到小的顺序是________。Al2O3晶体熔点高是耐火材料,AlCl3晶体易升华,熔点低,工业上电冶制取铝用前者而不用后者的原因是________。
(4)钙钛矿型复合氧化物也可作为汽车尾气转化的催化剂。一种复合氧化物晶胞结构如有图,则与每个Sr2+与_____个O2-紧邻;若Sr2+与O2-紧邻的核间距为apm,阿伏伽德罗常数为NA,则该氧化物晶体密度的计算表达式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物的量浓度、反应速率分别随时间的变化如下图所示:下列说法中正确的是
2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物的量浓度、反应速率分别随时间的变化如下图所示:下列说法中正确的是

A.8min前A的平均反应速率为0.17mol/ (L·min)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数均为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)![]() 2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝质轻且有良好的防腐蚀性,在国防工业、生产、生活中具有非常重要的作用。下图是从铝土矿中制备铝的工艺流程:

已知:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3、MgO杂质;回答下列问题:
I、(1)铝土矿加入盐酸过滤后所得滤渣A的主要成分为____________。
(2)在工艺流程中,加入足量氢氧化钠溶液发生的离子反应共有_________个,其中发生沉淀溶解的离子反应方程式为____________。
(3)邋入过量的二氧化碳时,生成沉淀的离子方程式为____________。
(4)电解氧化铝,每生成1molA1时,生成____g氧气。
Ⅱ、测铝土矿组分的质量分数。
(1)若铝土矿样品质量为m,对滤渣A洗涤、干燥后称重为m1;对滤渣B洗涤、干燥、灼烧后称重为m2,该方案能测得质量分数的成份且相应的质量分数是____________;
(2)洗涤滤渣A后的洗涤液是否需加入到第一次过滤后的滤液中_____(“是”或“否”);检测滤渣A是否洗涤干净的方法是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com