
����Ŀ��������M��һ�����ϣ��ɲ�����֬�뷼������������������Ϊ��Ҫԭ�ϣ�������·�ߺϳɣ�
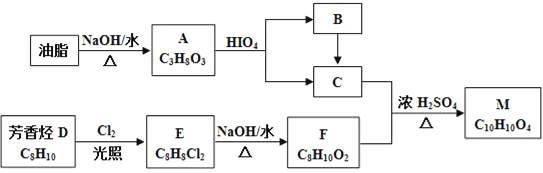
��֪����RX![]() ROH
ROH
��E������ֻ�����ֲ�ͬ��ѧ������Hԭ��
��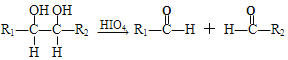
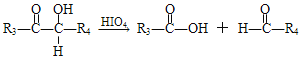
��R1��R2��R3��R4�������⡢�������������ţ�
��1��A�й����ŵ�������___��D��E�ķ�Ӧ����Ϊ___��
��2��E�Ľṹ��ʽΪ___��
��3��C+F��M�Ļ�ѧ����ʽ____��
��4�����л�����������F��ͬ���칹�����____��
a��![]()
b��![]()
c��![]()
d��CH2=CH��CH=CH��CH=CH��CH2COOH
��5��д����Br��CH2CH2��Br��HCOOCH2CH2OOCH�ĺϳ�·�ߣ����Լ���ѡ���ϳ�·�߲������е���д��ʽ��____��
���𰸡��ǻ� ȡ����Ӧ ![]() 2HCOOH+
2HCOOH+![]() 2H2O+
2H2O+![]() bd BrCH2CH2Br
bd BrCH2CH2Br![]() HOCH2CH2OH
HOCH2CH2OH![]() HCHO
HCHO![]() HCOOH
HCOOH ![]() HCOOCH2CH2OOCH
HCOOCH2CH2OOCH
��������
��֬ˮ��õ�AΪ![]() �������Ϣ�ۿ���A��������HCHO��HCOOH��B�����õ�C����BΪHCHO��CΪHCOOH��������D�������ڹ��������·�������ȡ����Ӧ����E��E������ֻ�����ֲ�ͬ��ѧ������Hԭ�ӣ���DΪ
�������Ϣ�ۿ���A��������HCHO��HCOOH��B�����õ�C����BΪHCHO��CΪHCOOH��������D�������ڹ��������·�������ȡ����Ӧ����E��E������ֻ�����ֲ�ͬ��ѧ������Hԭ�ӣ���DΪ![]() ��EΪ
��EΪ![]() ��FΪ
��FΪ![]() ��MΪ
��MΪ![]() ��
��
��1��AΪ![]() �����еĹ����ŵ��������ǻ���D��E�ķ�Ӧ����Ϊȡ����Ӧ���ʴ�Ϊ���ǻ���ȡ����Ӧ��
�����еĹ����ŵ��������ǻ���D��E�ķ�Ӧ����Ϊȡ����Ӧ���ʴ�Ϊ���ǻ���ȡ����Ӧ��
��2��E�Ľṹ��ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��3��C+F��M�Ļ�ѧ����ʽ��2HCOOH+![]() 2H2O+
2H2O+![]() ���ʴ�Ϊ��2HCOOH+
���ʴ�Ϊ��2HCOOH+![]() 2H2O+
2H2O+![]() ��
��
��4��F�Ľṹ��ʽΪ![]() ��
��![]() ��
��![]() ��F�ķ���ʽ��ͬ����F
��F�ķ���ʽ��ͬ����F![]() ��CH2=CH��CH=CH��CH=CH��CH2COOH��F�ķ���ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬�ʴ�Ϊ��bd��
��CH2=CH��CH=CH��CH=CH��CH2COOH��F�ķ���ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬�ʴ�Ϊ��bd��
��5��BrCH2CH2Br����������ˮ��Һ�����������·���ˮ�ⷴӦ����HOCH2CH2OH��Ȼ��HIO4��������HCHO����������������ͭ�����õ� HCOOH��������Ҷ�������������Ӧ�õ�HCOOCH2CH2OOCH���ϳ�·������ͼΪ��BrCH2CH2Br![]() HOCH2CH2OH
HOCH2CH2OH![]() HCHO
HCHO ![]() HCOOH
HCOOH![]() HCOOCH2CH2OOCH���ʴ�Ϊ��BrCH2CH2Br
HCOOCH2CH2OOCH���ʴ�Ϊ��BrCH2CH2Br ![]() HOCH2CH2OH
HOCH2CH2OH ![]() HCHO
HCHO ![]() HCOOH
HCOOH ![]() HCOOCH2CH2OOCH��
HCOOCH2CH2OOCH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. �ⶨHCl��NaOH�кͷ�Ӧ�ķ�Ӧ��ʱ������ʵ���Ӧ����3���¶ȣ���������ʼ�¶ȡ�NaOH��Һ��ʼ�¶Ⱥͷ�Ӧ��ֹ�¶�
B. ��2C(s)+O2(g)=2CO(g)��H=-221.0 kJ/mol����̼��ȼ����Ϊ110.5 kJ/mol
C. ��Ҫ���ȵķ�Ӧһ�������ȷ�Ӧ,�������ܷ����ķ�Ӧһ���Ƿ��ȷ�Ӧ
D. ��֪I����ӦH2(g)+Cl2(g)��2HCl(g)����H=-a kJ/mol
II: ![]()
��a��b��c�������㣬��Ͽ�1molH-Cl�����������Ϊ2(a+b+c)kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���Ҵ������������ϵ����Ӽ�����һ�����������ܱ�����Ϊ��ȩ���Ҵ�___��������������������ʹ����KMnO4��Һ��ɫ����֪�����£�2.3g�Ҵ���һ������������Ϻ��ȼ��ǡ����ȫȼ�գ��ų�68.35kJ��������÷�Ӧ���Ȼ�ѧ����ʽΪ___��
��2����֪��
��ѧ�� | Si��Cl | H��H | H��Cl | Si��Si |
����/kJ��mol��1 | 360 | 436 | 431 | 176 |
�ҹ辧����ÿ����ԭ�Ӻ�����4����ԭ���γ�4�����ۼ�����ҵ����ȡ�ߴ���ķ�Ӧ����ʽΪ��SiCl4(g)��2H2(g)![]() Si(s)��4HCl(g)���÷�Ӧ�ķ�Ӧ��Ϊ___kJ��mol��1��
Si(s)��4HCl(g)���÷�Ӧ�ķ�Ӧ��Ϊ___kJ��mol��1��
��3����֪ˮ�ı�����Ϊ4.18��10��3kJ��g-1��C-1��10g�����O2����ȫȼ��������̬SO2���ų���������ʹ500 g H2O���¶���18������62.4�棬����Ƶ�ȼ����Ϊ____���Ȼ�ѧ����ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ɳ�����ص�ԭ����ͼ��ʾ����֪a��bΪ������������Һ�����ԡ�����ʱ�Ҳ���Һ��ɫ����ɫ��Ϊ��ɫ������������ȷ����

A. ����ʱ��H�������Ǩ�����Ҳ�
B. ��������У������Һ��ɫ�ɻ�ɫ��Ϊ��ɫ
C. ����ʱ��b����ֱ����Դ������a����ֱ����Դ����
D. ��������У�a����������ӦʽΪ��VO2++2H++e�� = VO2++H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ᣨH3PO3���Ľṹ��ͼ��
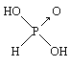
�Ǿ���ǿ��ԭ�ԵĶ�Ԫ���ᣬ���Ա�����������Ϊ���ᡣ
��1����֪���������PCl3ˮ����ɣ���д����Ӧ�����ӷ���ʽ____���������������ӷ�Ӧʱ�������뻹ԭ�������ʵ���֮��Ϊ____��
��2��ij�¶��£�0.1mol/L��H3PO3��Һ��pHΪ1.6����c(H+)=2.5��10-2mol/L���¶���H3PO3��һ������ƽ�ⳣ��![]() =____����H3PO3�ڶ���������Բ��ƣ����������λ��Ч���֣���H3PO3��Һ�еμ�NaOH��Һ�����ԣ�������Һ�У�
=____����H3PO3�ڶ���������Բ��ƣ����������λ��Ч���֣���H3PO3��Һ�еμ�NaOH��Һ�����ԣ�������Һ�У�![]() ____
____![]() ������>������<������=������
������>������<������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t��ʱ��A���ܽ����Sg��100g��1���䱥����Һ�ܶ�Ϊdg��cm��3�����ʵ���Ũ��Ϊcmol��L��1����Һ����������Ϊw��A��Ħ������ΪMg��mol��1��ʵ������һ������A����Һ�м���mg��ˮA��������ngˮ��ָ���t�棬��Ϊ������Һ�����й�ϵʽ��ȷ����(����)
A.S��![]()
B.c��![]()
C.S��![]()
D.c%��![]() 100%
100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.25��ʱ����pH=a��һԪǿ����Һ��pH=14��a��һԪ����Һ�������Ϻ�������Һ�����Ի�����
B.���������Һ�м���������Һ�����ԣ���c(Cl��)=c(CH3COOH)
C.�����£���֪CH3COOH�ĵ���ƽ�ⳣ��ΪKa��CH3COONa��ˮ��ƽ�ⳣ��ΪKh����Ka��Kw=Kh
D.��NH4HSO4��Һ�еμ�NaOH��Һ�����ԣ����û��Һ��c(Na��)>c(![]() )>c(
)>c(![]() )>c(OH��)��c(H��)
)>c(OH��)��c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H3BO3)������Ҫ��;��һԪ���ᡣ��ش��������⣺
(1)�����������ȵ�Ũ��������������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ___________��
(2)���������(��Ҫ�ɷ�ΪMg2B2O5��H2O��Fe3O4����������Fe2O3��FeO��CaO��Al2O3��SiO2��)�����ᣬ��֪��Ȼ��Fe3O4�������ᡣ��������Ĺ����������£�

�١���������Ҫ�ɷֵĻ�ѧʽΪ_____________��
�ڡ��������ӡ�����Һ����һ���¶ȣ����ȼ�H2O2��Һ��Ȼ���ٵ�����Һ��pH=5.6���¶Ȳ��˹��ߵ�ԭ����___________��������Һ��pH=5.6����ҪĿ����___________��
[��֪��Ksp[Fe(OH)3]=2.6��10-39]�� Ksp[Al(OH)3]=1.3��10-33��
[��֪��Ksp[Fe(OH)2]=4.7��10-6]�� Ksp[Mg(OH)2]=5.6��10-12��

(3)����Ҳ����ͨ����ⷽ���Ʊ�������ԭ����ͼ��ʾ��
��д�������ĵ缫��Ӧʽ___________________��
��aĤ��bĤΪ�����ӽ���Ĥ����________����������Һ��Ũ��________(���������䡱������С��)��
(4)д��һ������������������������Һ��Ӧ�Ļ�ѧ����ʽ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClNO)���л���ϳ��е���Ҫ�Լ�������NO��Cl2�ڳ��³�ѹ�·�Ӧ�õ���ClNO �����������£���ɫ���壬�۵㣺-59.6�棬�е㣺-6.4�棬��ˮ��ˮ�⡣ij�о���ѧϰС�������������(ClNO)��������ͨ�������ȡ�������ȣ����������ʵ��װ�á���
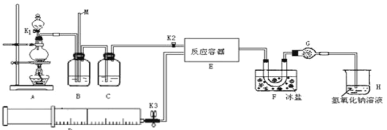
�Իش��������⣺
(1)д��ʵ��������װ��A�Ʊ�Cl2�����ӷ�Ӧ����ʽ__________��
(2)װ��B�������� ��__________����____________��
(3)����Aװ����ȡNO���壬B��Ӧ��ʢ��_________��
(4)ΪʹNO��Cl2ǡ����ȫ��Ӧ����ClNO����������E��ͨ��NO��Cl2������������ٱ�Ϊ___��
(5) �������A��B��C����ɵ�ʵ��װ�������ԵIJ���_________��
(6)װ��H����β������ͬѧ��Ϊβ���е�ij�����岻����ȫ�����ա�Ϊ�˳������β�����ɽ�β����________________ͬʱͨ��NaOH��Һ�С�
(7)��֪��ClNO��H2O��Ӧ����HNO2��HCl��
�����ʵ��֤�� HNO2�����____________��(���ṩ���Լ���1 molL-1HCl�� 1 molL-1HNO2��Һ�� NaNO2��Һ����ɫʯ����ֽ����ɫʯ����ֽ)��
��ͨ������ʵ��ⶨClNO��Ʒ�Ĵ��ȡ�ȡF������Һ��3.0 g ����ˮ�����Ƴ�250 mL ��Һ��ȡ��25.00 mL��Ʒ������ƿ�У���0.20 molL-1 AgNO3����Һ�ζ����յ㣬���ݱ���������Ϣ��Ӧѡ��____________��ָʾ�����ζ��յ��������______��
���� | Ag2CrO4 | AgCl | AgI | Ag2S |
��ɫ | ש��ɫ | ��ɫ | ��ɫ | ��ɫ |
Ksp | 1��10-12 | 1.56��10-10 | 8.3��10-17 | 6.3 ��10-50 |
���ı�AgNO3��Һ�����Ϊ20.00ml����������(ClNO)����������Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com