
【题目】已知亚磷酸(H3PO3)的结构如图,
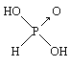
是具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式____。亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为____。
(2)某温度下,0.1mol/L的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2mol/L该温度下H3PO3的一级电离平衡常数![]() =____。(H3PO3第二步电离忽略不计,结果保留两位有效数字)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:
=____。(H3PO3第二步电离忽略不计,结果保留两位有效数字)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:![]() ____
____![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
【答案】PCl3+3H2O=H3PO3+3H++3Cl 2:1 8.3×103mol·L-1 =
【解析】
因为1 mol亚磷酸最多消耗2 mol氢氧化钠,所以亚磷酸是二元弱酸;弱电解质电离常数为达到平衡时所生成的各种离子浓度的幂之积与溶液中未电离的分子浓度的比值;溶液中粒子浓度关系根据电荷守恒和物料守恒判断。
(1)PCl3中P是+3,可以结合OH-,生成H3PO3,Cl-结合H+生成HCl,所以反应的离子方程式为:PCl3+3H2O=H3PO3+3H++3Cl-,故答案为:PCl3+3H2O=H3PO3+3H++3Cl;
(2)结合题目信息可知,亚磷酸与银离子反应生成银单质和磷酸,用H+和H2O来配平电荷和原子,离子方程式为:H3PO3+2Ag++H2O= H3PO4+2Ag+2H+。氧化剂银离子和还原剂亚磷酸的物质的量之比为2:1,故答案为:2:1;
(3)根据电离方程式:
H3PO3 ![]() H+ + H2PO3-
H+ + H2PO3-
起始浓度: 0.1 0 0
转化浓度:2.5×10-2 2.5×10-2 2.5×10-2
平衡浓度:0.1-2.5×10-2 2.5×10-2 2.5×10-2
电离平衡常数:Ka1=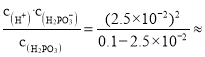 8.3×10-3mol·L-1,故答案为:8.3×10-3mol·L-1
8.3×10-3mol·L-1,故答案为:8.3×10-3mol·L-1
(4)根据电荷守恒:c(Na+)+ c(H+)=c(H2PO3-)+2c(HPO32-)+ c(OH-),溶液呈中性,c(H+)= c(OH-),因此c(Na+)= c(H2PO3-)+2c(HPO32-),故答案为:=。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.熵增原理不可独立作为反应自发性的判据
B.生产普通玻璃的主要原料为石灰石、纯碱和石英砂
C.硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等
D.6.4gCu与3.2g硫粉混合隔绝空气加热,充分反应后,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯氧化法处理CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
⑴某厂废水中含KCN(N为-3价,KOCN也是),其浓度为650mg·L-1。现用氯碱法处理,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O,被氧化的元素是_______。
⑵投入过量的液氯,可以将氰酸盐进一步氧化为N2,化学方程式为2KOCN+4KOH+3Cl2=N2↑+2CO2↑+6KCl+2H2O,若处理上述废水20L,使KCN完全转化为无毒物质,计算需要液氯的质量。___________若将所需液氯换成氯气,则所需氯气在标准状况下的体积为多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个
①pH=0的溶液中Fe3+与S2因发生双水解而不共存
②MgCl2溶液蒸干后得MgO固体,如果想要得到MgCl2固体应通入HCl的气流
③将0.1mol的Na2CO3溶于水中,形成溶液中阴离子总数小于0.1NA
④已知:AgCl(s)Ag+(aq)+Cl(aq),加少量水稀释平衡右移,c(Ag+)减小.
⑤![]() 和
和![]() 在溶液中因为互相抑制水解而大量共存
在溶液中因为互相抑制水解而大量共存
⑥pH=2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大
⑦NaHSO3溶液中加入少量NaOH固体,![]() 将增大
将增大
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答下列问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是_____(填字母)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性最高的是______(填反应类型)。
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:______,该方法的优点是_______。
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:

活性炭的作用是_______;O3消毒的优点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种香料,可采用油脂与芳香烃(含苯环的烃)为主要原料,按下列路线合成:
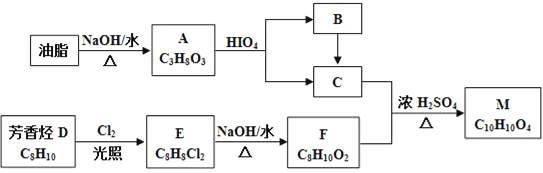
已知:①RX![]() ROH
ROH
②E分子中只有两种不同化学环境的H原子
③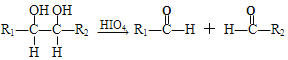
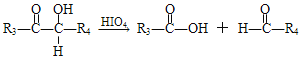
(R1、R2、R3与R4可能是氢、烃基或其他基团)
(1)A中官能团的名称是___,D→E的反应类型为___。
(2)E的结构简式为___。
(3)C+F→M的化学方程式____。
(4)下列化合物中属于F的同分异构体的是____。
a.![]()
b.![]()
c.![]()
d.CH2=CH﹣CH=CH﹣CH=CH﹣CH2COOH
(5)写出从Br﹣CH2CH2﹣Br→HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用胆矾制取氧化铜,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用,实验步骤如下:①称量ag胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;②过滤步骤①中的混合物,洗涤固体;③将②中的固体转移至蒸发皿中,加热至固体全部变成黑色氧化铜为止,称量所得固体质量为bg;④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气(装置如图所示)。请回答下列问题:
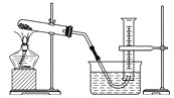
(1)上述各步操作中,需要用到玻璃棒的是________(填写前面所述实验步骤的序号)。
(2)由胆矾制得的氧化铜的产率(实际产量与理论产量的百分比)为________×100%。
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行的实验操作是__________(按实验先后顺序填写字母序号)。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有很大一部分同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
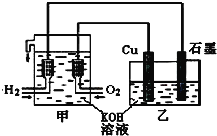
A.乙中Cu电极的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O
B.甲中通入氧气的电极为负极
C.乙中阴离子向石墨电极移动
D.电路上通过0.5mol电子,可制得0.5molCu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
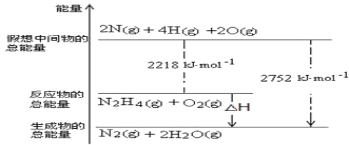
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为__________。
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/molL-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/molL-1min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲____________V丙,平衡常数K丙_________K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)H2NCOONH4(氨基甲酸铵)(l) △H1 ,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com