
【题目】下列说法正确的有几个
①pH=0的溶液中Fe3+与S2因发生双水解而不共存
②MgCl2溶液蒸干后得MgO固体,如果想要得到MgCl2固体应通入HCl的气流
③将0.1mol的Na2CO3溶于水中,形成溶液中阴离子总数小于0.1NA
④已知:AgCl(s)Ag+(aq)+Cl(aq),加少量水稀释平衡右移,c(Ag+)减小.
⑤![]() 和
和![]() 在溶液中因为互相抑制水解而大量共存
在溶液中因为互相抑制水解而大量共存
⑥pH=2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大
⑦NaHSO3溶液中加入少量NaOH固体,![]() 将增大
将增大
A.2个B.3个C.4个D.5个
【答案】A
【解析】
①pH=0的溶液中Fe3+与S2-会发生氧化还原反应生成硫沉淀和硫化亚铁沉淀,①错误;
②MgCl2溶液蒸干时氯化镁的水解程度增大,生成氢氧化镁沉淀,氢氧化镁分解得到MgO固体,如果想要得到MgCl2固体应通入HCl的气流,以抑制氯化镁水解,②正确;
③在Na2CO3溶液中存在碳酸钠的水解生成碳酸氢钠和氢氧化钠,阴离子总数增多,③错误;
④已知:AgCl(s)![]() Ag+(aq)+Cl-(aq),加水稀释平衡右移,c(Ag+)浓度不变,④错误;
Ag+(aq)+Cl-(aq),加水稀释平衡右移,c(Ag+)浓度不变,④错误;
⑤![]() 存在电离平衡,电离出的氢离子与
存在电离平衡,电离出的氢离子与![]() 反应生成氢氧化铝沉淀,促进碳酸氢根电离,⑤错误;
反应生成氢氧化铝沉淀,促进碳酸氢根电离,⑤错误;
⑥没有注明盐酸和醋酸溶液的体积相等,无法判断,⑥错误;
⑦NaHSO3溶液中加入少量NaOH固体,促进亚硫酸氢根的电离,![]() 将增大,⑦正确;
将增大,⑦正确;
综上所述,正确的有2个,答案选A。


科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:___________________________。
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.阅读下列材料后,回答相应问题:一个体重50kg的健康人的体内含铁2g。这2g铁在人体内不是以单质的形式存在的,而是以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于铁的吸收。
⑴人体中经常进行![]() 的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
⑵“服用维生素C,可使食物中的Fe3+转化为Fe2+”,这句话指出维生素C在这一反应中做________剂,具有________性。
Ⅱ.某化工厂排出的废液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用CO32-、OH-、Cl-三种不同的阴离子分别将上述金属阳离子逐一形成沉淀除去。加入阴离子的正确顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙醇常被用做饮料的添加剂,在一定的条件下能被氧化为乙醛,乙醇___(“能”或“不能”)使酸性KMnO4溶液褪色;已知常温下,2.3g乙醇和一定量的氧气混合后点燃,恰好完全燃烧,放出68.35kJ热量,则该反应的热化学方程式为___。
(2)已知:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键,工业上制取高纯硅的反应方程式为:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
(3)已知水的比热容为4.18×10-3kJ·g-1·C-1。10g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500 g H2O的温度由18℃升至62.4℃,则硫黄的燃烧热为____,热化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
(1)将褐色硬块处理成粉末状。研究小组首先排除了含有单质Al杂质的可能性,实验方法是__,证明不含单质铝的现象是__。
(2)该褐色硬块的组成基本确定为Fe、Fe2O3,Al2O3。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3 mol·L-1NaOH、3mol·L-1HCl、3mol·L-1HNO3、3mol·L-1CuSO4、0.01mol·L-1KMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是

A. 放电时,H+从左槽迁移进右槽
B. 放电过程中,左槽溶液颜色由黄色变为蓝色
C. 充电时,b极接直流电源正极,a极接直流电源负极
D. 充电过程中,a极的电极反应式为:VO2++2H++e- = VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图,
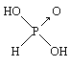
是具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式____。亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为____。
(2)某温度下,0.1mol/L的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2mol/L该温度下H3PO3的一级电离平衡常数![]() =____。(H3PO3第二步电离忽略不计,结果保留两位有效数字)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:
=____。(H3PO3第二步电离忽略不计,结果保留两位有效数字)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:![]() ____
____![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.25℃时,将pH=a的一元强酸溶液与pH=14﹣a的一元碱溶液等体积混合后,所得溶液呈酸性或中性
B.向醋酸钠溶液中加盐酸至溶液呈中性,则c(Clˉ)=c(CH3COOH)
C.常温下,已知CH3COOH的电离平衡常数为Ka、CH3COONa的水解平衡常数为Kh、则Ka·Kw=Kh
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液中c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)上述反应中生成二氧化硫的化学方程式为__。
(2)乙同学认为还可能产生氢气的理由是__。
(3)丙同学在安装好装置后,必不可少的一步操作是__。
(4)说明A、B、E中可能的试剂及其作用:
①A中加入的试剂可能是__,作用是__;
②B中加入的试剂可能是__,作用是__;
③E中加入的试剂可能是__,作用是__。
(5)可以证明气体X中含有氢气的实验现象是:C中__;D中__。
(6)如果去掉装置B,还能否根据D中的现象判断气体X中有氢气__(填“能”或“不能”),原因是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com