
【题目】(1)乙醇常被用做饮料的添加剂,在一定的条件下能被氧化为乙醛,乙醇___(“能”或“不能”)使酸性KMnO4溶液褪色;已知常温下,2.3g乙醇和一定量的氧气混合后点燃,恰好完全燃烧,放出68.35kJ热量,则该反应的热化学方程式为___。
(2)已知:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键,工业上制取高纯硅的反应方程式为:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
(3)已知水的比热容为4.18×10-3kJ·g-1·C-1。10g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500 g H2O的温度由18℃升至62.4℃,则硫黄的燃烧热为____,热化学方程式为____。
【答案】能 C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l) ΔH=-1367 kJ·mol1 +236 297kJ·mol1 S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol1
【解析】
(1)乙醇具有还原性;2.3g乙醇和一定量的氧气混合后点燃,恰好完全燃烧,放出68.35kJ热量,则1mol乙醇完全燃烧放出的热量为68.35 kJ×![]() =1367kJ;
=1367kJ;
(2)焓变=反应物的总键能-生成物的总键能;
(3)S的燃烧热是1molS完全燃烧生成二氧化硫气体放出的热量;
(1)乙醇具有还原性,能够被酸性KMnO4氧化,能使酸性KMnO4溶液褪色;2.3 g乙醇的物质的量为![]() =0.05mol,和一定量的氧气混合后点燃,恰好完全燃烧,放出68.35 kJ热量,则1mol乙醇完全燃烧放出的热量为68.35 kJ×
=0.05mol,和一定量的氧气混合后点燃,恰好完全燃烧,放出68.35 kJ热量,则1mol乙醇完全燃烧放出的热量为68.35 kJ×![]() =1367kJ,反应的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1367 kJ·mol1;
=1367kJ,反应的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1367 kJ·mol1;
(2)硅晶体中每个硅原子和其他4个硅原子形成4个共价键,则1mol硅含有2mol Si—Si;ΔH=反应物总键能-生成物总键能,则SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) ΔH=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236kJ/mol;
Si(s)+4HCl(g) ΔH=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236kJ/mol;
(3)10g硫磺燃烧共放出热量为:Q=m·c(t2-t1)=500g×4.18×10-3 kJ·(g·℃)-1×(62.4-18)℃=92.8 kJ,则1mol(32g)硫磺燃烧放出的热量为:92.8kJ×![]() =297 kJ,所以硫磺的燃烧热为297kJ·mol-1,热化学方程式为S(s)+O2(g)=SO2(g) ΔH=-297kJ·mol1。
=297 kJ,所以硫磺的燃烧热为297kJ·mol-1,热化学方程式为S(s)+O2(g)=SO2(g) ΔH=-297kJ·mol1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某简单(单核)粒子的原子核外有18个电子。
(1)若为原子,请画出其原子结构示意图_________。
(2)若为阳离子,请写出其常见的离子符号_______。
(3)若为阴离子,请写出其常见的离子符号_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度
B. 若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D. 已知I:反应H2(g)+Cl2(g)=2HCl(g);△H=-a kJ/mol
II: ![]()
且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a+b+c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯氧化法处理CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
⑴某厂废水中含KCN(N为-3价,KOCN也是),其浓度为650mg·L-1。现用氯碱法处理,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O,被氧化的元素是_______。
⑵投入过量的液氯,可以将氰酸盐进一步氧化为N2,化学方程式为2KOCN+4KOH+3Cl2=N2↑+2CO2↑+6KCl+2H2O,若处理上述废水20L,使KCN完全转化为无毒物质,计算需要液氯的质量。___________若将所需液氯换成氯气,则所需氯气在标准状况下的体积为多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种大气污染物,工业上可用NaClO碱性溶液吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。该催化过程如图所示,下列有关说法不正确的是( )
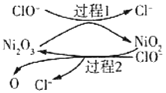
A.当溶液中c(ClO-)相同时,用Ca(ClO)2脱硫效果比用NaClO好
B.过程2中产生的原子氧可加快对SO2的吸收
C.过程2的离子方程式为2NiO2+ClO-=Ni2O3+Cl-+2O
D.H2SO3的酸性比HClO强,所以SO2能与NaClO溶液反应生成HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有几个
①pH=0的溶液中Fe3+与S2因发生双水解而不共存
②MgCl2溶液蒸干后得MgO固体,如果想要得到MgCl2固体应通入HCl的气流
③将0.1mol的Na2CO3溶于水中,形成溶液中阴离子总数小于0.1NA
④已知:AgCl(s)Ag+(aq)+Cl(aq),加少量水稀释平衡右移,c(Ag+)减小.
⑤![]() 和
和![]() 在溶液中因为互相抑制水解而大量共存
在溶液中因为互相抑制水解而大量共存
⑥pH=2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大
⑦NaHSO3溶液中加入少量NaOH固体,![]() 将增大
将增大
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
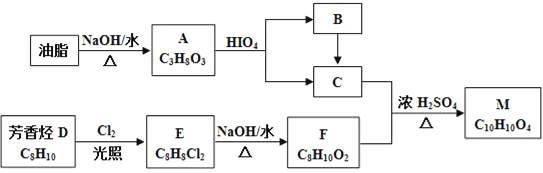
【题目】化合物M是一种香料,可采用油脂与芳香烃(含苯环的烃)为主要原料,按下列路线合成:
已知:①RX![]() ROH
ROH
②E分子中只有两种不同化学环境的H原子
③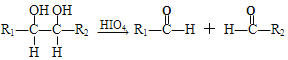
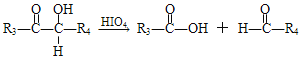
(R1、R2、R3与R4可能是氢、烃基或其他基团)
(1)A中官能团的名称是___,D→E的反应类型为___。
(2)E的结构简式为___。
(3)C+F→M的化学方程式____。
(4)下列化合物中属于F的同分异构体的是____。
a.![]()
b.![]()
c.![]()
d.CH2=CH﹣CH=CH﹣CH=CH﹣CH2COOH
(5)写出从Br﹣CH2CH2﹣Br→HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
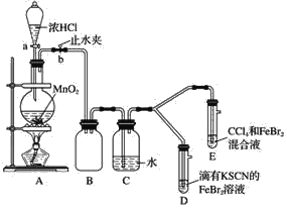
(1)①装置A中发生反应的离子方程式是______________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:

①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加____________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com