
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
【答案】C
【解析】
A. 依据化学平衡移动原理,结合影响因素分析判断;
B.可根据反应物的浓度改变与平衡移动的关系,结合含N元素的化合物分析;
C.根据可逆反应达到平衡时,任何物质的浓度不变分析;
D.催化剂能加快反应速率,但不影响平衡的移动。
A.由于该反应的正反应为放热反应,升高温度,平衡向吸热的逆反应方向移动,所以升高温度可使该反应的平衡常数减小,A错误;
B.NH3是反应物,增大反应物的浓度,可以使平衡正向移动,NO的转化率提高,而NH3的转化率降低,B错误;
C.根据方程式可知,在任何条件下每反应消耗1molNO,会同时产生2molN2,现在单位时间内消耗NO和N2的物质的量比为1:2,说明正反应速率与逆反应速率相等,则NO、N2的浓度不变,因此反应达到平衡状态,C正确;
D.在其他条件不变时,使用高效催化剂,可以加快化学反应速率,但由于对正、逆反应速率的影响相同,所以平衡不发生移动,因此废气中氮氧化物的转化率不变,D错误;
故合理选项是C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0 t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备“三盐”的工艺流程如图所示。
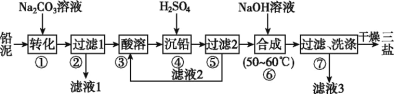
已知:①Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;②铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式:_____,该反应能发生的原因是________。
(2)步骤②“过滤1”后所得滤渣的主要成分为__________。
(3)步骤③“酸溶”,最适合选用的酸为__,为提高酸溶速率,可采取的措施是___________(任意写出一条)。
(4)从原子利用率的角度分析该流程的优点为__________。
(5)步骤⑥“合成”的化学方程式为___________________。若得到纯净干燥的“三盐”49.5 t,假设铅泥中的铅元素有80%转化为“三盐”,则铅泥中铅元素的质量分数为____%(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”进课堂,某化学教师为氯气与金属钠反应设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置作如下图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
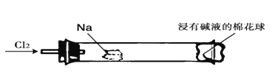
A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 若在棉球外沿滴一滴淀粉碘化钾溶液,据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g)![]() 2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度
A. ①②④ B. ②③ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,两种钠盐![]() 、
、![]() 溶液的物质的量浓度均为
溶液的物质的量浓度均为![]() ,加水稀释时溶液的
,加水稀释时溶液的![]() 与稀释倍数的对数
与稀释倍数的对数![]() 的关系如图所示。下列判断错误的是( )
的关系如图所示。下列判断错误的是( )
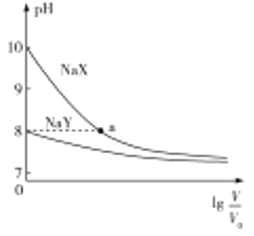
A.![]() 、
、![]() 均为弱酸,且
均为弱酸,且![]() 的酸性比
的酸性比![]() 的强
的强
B.![]() 的
的![]() 、
、![]() 溶液中,前者对水的电离促进作用较大
溶液中,前者对水的电离促进作用较大
C.![]() 点
点![]() 溶液中存在:
溶液中存在:![]()
D.随着溶液的稀释,![]() 溶液中
溶液中![]() 逐渐减小
逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锆石(ZrSiO4)酷似钻石且价格低廉,是钻石很好的代用品。天然锆石的主要成分是ZrSiO4,另外还常含有Fe、Al、Cu的氧化物杂质。工业上以天然锆石为原料制备ZrO2的工艺流程如下:
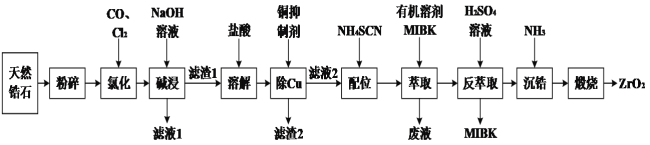
已知:i.氯化过程中除C、O外,其他元素均转化为其最高价氯化物;
ⅱ.Zr在化合物中通常显+4价;ZrC14易溶于水,400 ℃时升华;
ⅲ.“配合”生成的Fe(SCN)3难溶于MIBK,Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度。
(1)将锆石“粉碎”的目的是_______________________________。
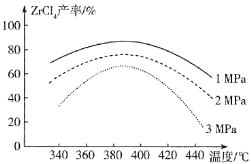
(2)“氯化”过程中,ZrSiO4发生反应的化学方程式为_______________,由下图可知,“氯化”过程选择的最佳反应条件是_________ ;若“氯化”温度过高会导致ZrC14产率降低,原因是________。
(3)常用的铜抑制剂为NaCN,它可与重金属离子生成沉淀,如Cu(CN)2,其Ksp=4.0×10-10。已知盐酸溶解后的溶液中Cu2+的浓度为1mol·L-1,若溶液中Cu2+的浓度小于等于1.0×10-6mol·L-1时可视为沉淀完全,则Cu2+沉淀完全时溶液中CN-的浓度为________molL-1。
(4)由于NaCN有剧毒,所以需要对“废液”中的NaCN进行处理,通常选用漂白液(有效成分是NaClO)在碱性条件下将其氧化,其产物之一是空气中的主要成分,则上述反应的离子方程式为___________。
(5)流程中“萃取”与“反萃取”可以分离铁、富集锆,简述“萃取”的原理:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3的混合物)为原料制备Mg(OH)2和CaCO3的工艺流程如下:
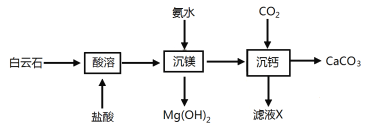
下列说法不正确的是
A.酸溶生成Mg2+的离子方程式是:MgCO3+2H+= Mg2++CO2↑+H2O
B.流程中可以循环利用的物质是CO2
C.酸溶过程中盐酸可用稀硝酸或硫酸代替
D.流程中没有涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法在化学学习中起到了重要的作用。已知下列物质:①NaOH溶液、②NO2、③Fe(OH)3、④熔融NaCl、⑤SO2、⑥氨水。回答下列相关问题:
(1)属于混合物的有______________________(填序号,下同)。
(2)属于电解质的有_________________。
(3)能导电的有_____________________。
(4)实验室制备少量Fe(OH)3胶体的离子方程式是_____。
(5)实验室用NaOH溶液吸收NO2的化学方程式为2NO+2NaOH=NaNO2+ NaNO3+H2O,则该反应中氧化剂与还原剂的物质的量之比为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为2NA
B.7gCnH2n中含有的氢原子数目为NA
C.任何气体单质在标况下体积若为22.4L,则含有2NA个原子
D.1molNa2O2与水反应转移的电子数约为1.204×1024个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com