
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )

A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性W比Z弱
C.Y的气态氢化物的稳定性较Z的弱
D.四种元素的单质中,Z的熔、沸点最高
【答案】D
【解析】
X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子只能有2个电子层,最外层电子数为6,所以Y为氧元素;根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素,据此分析解答。
根据上述分析,X为氮元素,Y为氧元素,Z为硫元素,W为氯元素。
A.同一周期的元素从左到右原子半径逐渐减小,故原子半径Z>W、X>Y,故A错误;
B.非金属性越强,其最高价氧化物对应水化物的酸性越强,Z为硫元素,W为氯元素,非金属性W>Z,故最高价氧化物对应水化物的酸性W>Z,故B错误;
C.非金属性越强,其简单气态氢化物的稳定性越强,非金属性Y>Z,故Y的气态氢化物的稳定性较Z的强,故C错误;
D.四元素的单质中,硫常温下为固体,其它三种为气体,故硫的熔、沸点最高,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】—定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为l.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t ℃)时,水的Kw=1×10-12,则该温度____(填“>”“<”或“=”)25 ℃,其理由是_________________________________________________________。
(2)该温度下,c(H+)=1×10-7 mol/L的溶液呈_____(填“酸性、碱性或中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=________ mol/L。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡______(填“向左” “向右”或“不”,下同 )移动。在新制氯水中加入少量的NaCl固体,水的电离平衡________移动。
(4)25 ℃时,pH=4的盐酸中水的电离程度________(填“大于”“小于”或“等于”)pH=10的Ba(OH)2溶液中水的电离程度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行一氯取代后,只能生成四种沸点不同的有机物,则该烷烃是( )
A.(CH3)2CHCH2CH2CH3B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2D.(CH3)3CCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1一般采用700 K左右的温度,其原因是( )
2NH3(g) ΔH=-92.4 kJ·mol-1一般采用700 K左右的温度,其原因是( )
①提高H2的转化率 ②适当提高氨的合成速率 ③提高氨的产率 ④催化剂在700 K时活性最大
A.只有①B.②④C.②③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.![]() 溶于水的电离方程式为
溶于水的电离方程式为![]() ,向
,向![]() 溶液中加入少量
溶液中加入少量![]() 固体,电离平衡正向移动
固体,电离平衡正向移动
B.![]() 在熔融状态下的电离方程式为
在熔融状态下的电离方程式为![]() ,向醋酸中加入少量
,向醋酸中加入少量![]() 固体,电离平衡逆向移动
固体,电离平衡逆向移动
C.向稀氨水中滴加少量![]() ,溶液,
,溶液,![]() 与
与![]() 结合生成
结合生成![]() ,使平衡正向移动,电离常数增大
,使平衡正向移动,电离常数增大
D.常温下,冰醋酸加水稀释的过程中,溶液的导电能力先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质溶液有关叙述正确的是
A.恒温条件下稀释氢氟酸时,HF的Ka增大,水的KW不变
B.向Mg(OH)2沉淀悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH-)浓度均增大
C.0.1mol/LNaHCO3溶液中,c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.0.1mol/LNa2SO3溶液中,加入少量NaOH固体,c(![]() )与c(Na+)均增大
)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌碘液流电池具有高电容量、对环境友好、不易燃等优点,可作为汽车的动力电源。该电池采用无毒ZnI2水溶液作电解质溶液,放电时将电解液储罐中的电解质溶液泵入电池,其装置如右图所示。下列说法不正确的是

A.M是阳离子交换膜
B.充电时,多孔石墨接外电源的正极
C.充电时,储罐中的电解液导电性不断增强
D.放电时,每消耗1molI3-,有1 molZn2+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:A(g)+B(g)![]() C(s)+D(g) △H<0,正、逆反应速率变化如图所示(υ代表反应速率,t代表时间),则t1时改变平衡的一个条件是
C(s)+D(g) △H<0,正、逆反应速率变化如图所示(υ代表反应速率,t代表时间),则t1时改变平衡的一个条件是
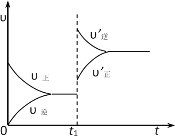
A.加入了正催化剂
B.加大了体系的压强
C.增加了体系的温度
D.加大了反应物的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com