
【题目】下列说法正确的是![]()
A.![]() 溶于水的电离方程式为
溶于水的电离方程式为![]() ,向
,向![]() 溶液中加入少量
溶液中加入少量![]() 固体,电离平衡正向移动
固体,电离平衡正向移动
B.![]() 在熔融状态下的电离方程式为
在熔融状态下的电离方程式为![]() ,向醋酸中加入少量
,向醋酸中加入少量![]() 固体,电离平衡逆向移动
固体,电离平衡逆向移动
C.向稀氨水中滴加少量![]() ,溶液,
,溶液,![]() 与
与![]() 结合生成
结合生成![]() ,使平衡正向移动,电离常数增大
,使平衡正向移动,电离常数增大
D.常温下,冰醋酸加水稀释的过程中,溶液的导电能力先增大后减小
【答案】D
【解析】
A.![]() 是二元弱酸,在水溶液中分步电离且电离程度都较小,其第一步电离方程式为
是二元弱酸,在水溶液中分步电离且电离程度都较小,其第一步电离方程式为![]() ,向
,向![]() 溶液中加入少量
溶液中加入少量![]() 固体,生成不溶于稀盐酸的CuS沉淀而促进硫化氢电离,故A错误;
固体,生成不溶于稀盐酸的CuS沉淀而促进硫化氢电离,故A错误;
B.![]() 在熔融状态下的电离生成钾离子和硫酸氢根离子,电离方程式为
在熔融状态下的电离生成钾离子和硫酸氢根离子,电离方程式为![]() ,在水溶液中完全电离生成钾离子、氢离子和硫酸根离子,电离方程式为
,在水溶液中完全电离生成钾离子、氢离子和硫酸根离子,电离方程式为![]() ;向醋酸溶液中加入少量
;向醋酸溶液中加入少量![]() 固体,
固体,![]() 电离出
电离出![]() 而抑制醋酸电离,醋酸电离平衡逆向移动,故B错误;
而抑制醋酸电离,醋酸电离平衡逆向移动,故B错误;
C.向稀氨水中加入少量![]() ,溶液中
,溶液中![]() 增大而抑制一水合氨电离,一水合氨电离平衡逆向移动,电离平衡常数只与温度有关,温度不变电离平衡常数不变,故C错误;
增大而抑制一水合氨电离,一水合氨电离平衡逆向移动,电离平衡常数只与温度有关,温度不变电离平衡常数不变,故C错误;
D.常温下,冰醋酸中加水稀释过程中,溶液中![]() 先增大后减小,溶液导电性与离子浓度成正比,所以溶液导电性先增大后减小,故D正确;
先增大后减小,溶液导电性与离子浓度成正比,所以溶液导电性先增大后减小,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。试回答:
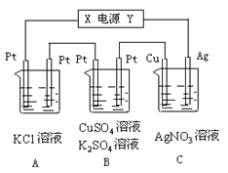
(1)电源电极X名称为_________(填“正极”或“负极”)
(2)烧杯中溶液的 pH变化:(填“增大”、“减小”或“不变”)B池________________,C池________________。
(3)写出A池中所发生的电解反应方程式:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NA代表阿伏加德罗常数,1mol C4H10中含共价键数目为14NA
B.某反应的ΔH = -88kJmol-1,则正反应活化能一定小于88kJmol-1
C.已知某温度下,Kw = 1×10-13,若将pH =8的NaOH溶液与pH =5的H2SO4溶液混合保持温度不变,欲使混合溶液pH =7,则NaOH溶液与H2SO4溶液的体积比为11:9
D.将浓度为0.1molL-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )

A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性W比Z弱
C.Y的气态氢化物的稳定性较Z的弱
D.四种元素的单质中,Z的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,将
时,将![]() 的盐酸与b
的盐酸与b![]() 的氨水等体积混合,反应后溶液呈中性
的氨水等体积混合,反应后溶液呈中性![]() 忽略溶液混合后体积的变化
忽略溶液混合后体积的变化![]() 下列说法不正确的是
下列说法不正确的是![]()
A.此时水的电离程度并不是最大
B.混合溶液中的离子浓度:![]()
C.此时溶液中![]() 的浓度为
的浓度为![]()
D.用含b的代数式不能表示![]() 时
时![]() 的电离常数
的电离常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示实验装置,X为直流电源的负极。甲池中充满H2SO4溶液,再分别插入铂电极。乙池中盛有AgNO3溶液,F、G为石墨电极。
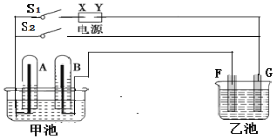
切断开关S2,闭合开关S1,通直流电一段时间
①甲池总反应方程式:____________;
②F电极反应方程式:___________;
③G电极的现象:______________;
④若F电极增重10.8g,B极上放出气体的体积(STP)是_______L;
⑤切断电源开关S1,闭合开关S2,此时甲池为__________(填原电池、电解池),A电极反应方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者小于后者的是
①C(s)+ ![]() O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
②S(g)+O2(g) ===SO2(g);ΔH3 S(s)+O2(g) ===SO2(g);ΔH4
③CaO(s)+H2O(l) ===Ca(OH)2(s);ΔH5 CaCO3(s) ===CaO(s)+CO2(g);ΔH6
A.② B.①② C.①③ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com