
【题目】工业上合成氨N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1一般采用700 K左右的温度,其原因是( )
2NH3(g) ΔH=-92.4 kJ·mol-1一般采用700 K左右的温度,其原因是( )
①提高H2的转化率 ②适当提高氨的合成速率 ③提高氨的产率 ④催化剂在700 K时活性最大
A.只有①B.②④C.②③④D.①②
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置,可以验证![]() 和 HCl的有关性质。实验前a、b、c活塞均关闭。
和 HCl的有关性质。实验前a、b、c活塞均关闭。

(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是 ______
(2)若先打开a、c 活塞,再挤压胶头滴管![]() 假设
假设![]() 不被完全吸收
不被完全吸收![]() ,在烧瓶Ⅱ中可观察到的现象 ______
,在烧瓶Ⅱ中可观察到的现象 ______ ![]()
(3)通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp(BaSO4)=1.0×1010。该温度下,CaSO4悬浊液中c(Ca2+)与c(SO42)的关系如图所示,下列叙述正确的是( )

A.向a点的溶液中加入等物质的量固体Na2SO4或Ca(NO3)2,析出的沉淀量不同
B.a、b、c、d四点对应的体系中,d点体系最稳定
C.升高温度后,溶液可能会由a点转化为b点
D.反应Ba2+(aq) + CaSO4(s)![]() BaSO4(s) + Ca2+(aq)的平衡常数K=9×104
BaSO4(s) + Ca2+(aq)的平衡常数K=9×104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在如图装置中进行实验,向a中加入0.5mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。

①仪器a的名称是__,仪器b的作用为__。
②能说明甲醛具有还原性的实验现象是__。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物含H2不含CO,将装置A和如图所示的装置连接后进行实验。

①依次连接的合理顺序为A→B→___→____→___→___→G;___
②装置B的作用是___;
③确认气体产物中含H2而不含CO的现象是___。
(3)已知:![]()
![]()
![]()
![]()
![]() 。设计实验证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,___,则说明甲醛的碳元素未被氧化成+4价。
。设计实验证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,___,则说明甲醛的碳元素未被氧化成+4价。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):

已知:i:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)。
[Cu(NH3)4]2+(蓝色)。
ⅱ:2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )

A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性W比Z弱
C.Y的气态氢化物的稳定性较Z的弱
D.四种元素的单质中,Z的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示。下列关于整个反应过程中的叙述错误的是

A. Oa段反应的化学方程式是Ba(OH)2+CO2 =BaCO3↓+H2O
B. bc段与cd段所消耗CO2的体积相同
C. bc段反应的离子方程式是2AlO2-+3H2O+CO2 = 2Al(OH)3↓+CO32-
D. de段沉淀减少是由于BaCO3固体的消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下HF的电离常数Ka=3.3×10-4 ,CaF2的溶度积常数Ksp=1.46×10-10。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是
A. 该温度下,0.31 mol·L-1的HF溶液的pH=2
B. 升高温度或增大浓度,HF的电离平衡常数都将增大
C. 两溶液混合不会产生沉淀
D. 向饱和的CaF2溶液中加入少量CaCl2固体后,溶度积常数Ksp一定比之前减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L恒容密闭容器中充入1.0molA和1.0molB,发生反应A(g)+B(g)![]() C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
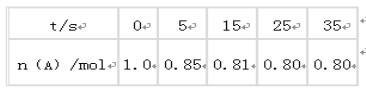
A.反应在前5s的平均速率v(A)= 0. 17mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则反应的△H>0
C.相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 molA、0.20 molB和1.0molC,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com