
【题目】某小组研究第3周期元素性质的递变规律,设计了如下实验,并记录了实验现象:
实验步骤 | 实验现象 |
①将一小块钠放入滴有酚酞的冷水中 | A.有气体产生,溶液变成浅红色 |
②将用砂纸打磨过的镁条放入沸水中,再向其中滴加少量酚酞溶液 | B.浮在水面上,熔成小球,做不定向运动,随后消失,溶液变为红色 |
③将镁条放入稀盐酸中 | C.反应较快,产生无色气体 |
④将铝条放入稀盐酸中 | D.反应剧烈,迅速产生大量无色气体 |
(1)补齐实验步骤与实验现象之间的连线___________。

(2)由上述实验可知Na、Mg、Al三种元素原子失电子能力(金属性)依次_______(填“增强”或“减弱”)。从原子结构的角度解释原因____________。
(3)比较第3周期中硫与氯两种元素原子得电子能力(非金属性)的相对强弱。
①甲同学设计的下列方法可行的是_______。
A.比较气态氢化物的稳定性 B.比较盐酸与硫酸的酸性 C.比较单质与酸反应置换出氢气的难易程度
②乙同学设计将氯气通入硫化钠溶液中,观察是否有淡黄色沉淀生成。这一实验的设计思路是通过比较________,推知元素原子得电子能力的相对强弱。
(4)利用元素周期律可预测陌生元素及物质的性质,已知Rb与Na处于同一主族,下列说法正确的是_____。
A.失电子能力:Rb>Na B.碱性:NaOH>RbOH C.Rb比Na更容易与氧气发生反应 D.Rb不易与水反应放出H2
【答案】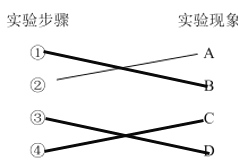 减弱 当电子层数相同时,随着核电荷数的增加,原子半径减小,原子核对最外层电子的吸引力增强,所以失电子能力依次减弱 A 单质的氧化性强弱 AC
减弱 当电子层数相同时,随着核电荷数的增加,原子半径减小,原子核对最外层电子的吸引力增强,所以失电子能力依次减弱 A 单质的氧化性强弱 AC
【解析】
同周期从左向右原子半径减小,原子核对最外层电子的吸引能力增强,失电子能力减弱、得电子能力增强,因此金属性逐渐减弱、非金属性增强,比较金属性一般采用单质与水或酸反应的剧烈程度判断;比较非金属性一般从置换反应或最高价含氧酸的酸性强弱进行判断;据此分析;
(1)①钠与水反应,因为钠的密度小于水,因此浮在水面上,钠与水反应是放热反应,钠的熔点较低,钠与水反应钠熔成小球,钠与水的反应:2Na+2H2O=2NaOH+H2↑,产生气体推动小球四处游动,因生成NaOH,使溶液显红色,①对应的现象是B;Mg比Al活泼,因此Mg与盐酸反应剧烈程度强于Al,因此③对应现象是D,④对应现象是C;连线为 ;
;
(2)Na与冷水反应,Mg与沸水反应,说明Na的金属性强于Mg,Mg与稀盐酸的反应剧烈程度强于Al,因此说明Mg的金属性强于Al,因此三者金属性由强到弱的顺序是Na>Mg>Al;原因是:三种元素的电子层数相同,随着核电荷数的增加,原子半径减小,原子核对最外层电子的吸引力增强,失电子能力减弱;
(3)①A.一般来说,非金属性越强,其气态氢化物稳定性越强,比较气态氢化物的稳定性,可以比较两种元素的非金属性强弱,故A符合题意;
B.一般非金属性越强,其最高价氧化物对应水化物的酸性越强,但盐酸中Cl不是最高价,因此比较盐酸与硫酸的酸性,不能判断两种元素的非金属性,故B不符合题意;
C.Cl2、S不与酸反应产生H2,故C不符合题意;
答案选A。
②氯气通入硫化钠溶液中,如果观察到有淡黄色沉淀生成,该淡黄色沉淀为S单质,说明发生反应:Cl2+S2-=S↓+2Cl-,Cl2为氧化剂,S为氧化产物,利用氧化剂的氧化性强于氧化产物的氧化性,推出Cl2的氧化性强于S,从而推出Cl的非金属性强于S;
(4)A.Rb在Na的下面,Rb和Na属于同主族,同主族从上到下,原子半径增大,失电子能力增强,即失电子能力:Rb>Na,故A说法正确;
B.金属性越强,其最高价氧化物对应水化物的碱性越强,Rb的金属性强于Na,因此碱性RbOH>NaOH,故B说法错误;
C.Rb的金属性强于钠,则Rb比Na更容易与氧气发生反应,故C说法正确;
D.Rb与Na属于同主族,性质具有相似性和递变性,因为Rb的金属性强于Na,因此Rb易于水反应放出H2,故D说法错误;
答案选AC。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图表示反应2SO2(g)+O2(g)![]() 2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
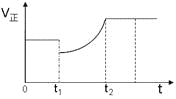
A.t1时减小了SO2的浓度,增加了SO3的浓度
B.t1时降低了温度,平衡向正反应方向移动
C.t1时减小了压强,平衡向逆反应方向移动
D.t1时增加了SO2和O2的浓度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为l.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将SO2与足量O2置于密闭容器中发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。
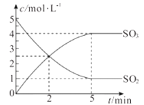
(1)0~2min以SO2表示的化学反应速率为_____mol·L-1min-1。
(2)5min后c(SO2)与c(SO3)不再随时间改变的原因是_________。
(3)由图像可知SO2与O2的反应是可逆反应,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。一定条件下,向体积为1L的恒容密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。一定条件下,向体积为1L的恒容密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是( )
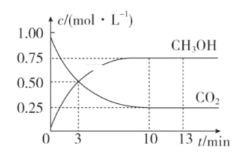
A.3min时,用CO2的浓度表示的υ(正)等于用CH3OH的浓度表示的υ(逆)
B.从0-10min,用H2表示的平均反应速率v(H2)=0.75mol·L-1·min-1
C.13min时,向容器中充入2mol氦气,该反应的化学反应速率增加
D.从反应达到平衡状态时,CO2的平衡转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A.反应在前2 s的平均速率υ(O2)=0.4 mol·L1·s1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t ℃)时,水的Kw=1×10-12,则该温度____(填“>”“<”或“=”)25 ℃,其理由是_________________________________________________________。
(2)该温度下,c(H+)=1×10-7 mol/L的溶液呈_____(填“酸性、碱性或中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=________ mol/L。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡______(填“向左” “向右”或“不”,下同 )移动。在新制氯水中加入少量的NaCl固体,水的电离平衡________移动。
(4)25 ℃时,pH=4的盐酸中水的电离程度________(填“大于”“小于”或“等于”)pH=10的Ba(OH)2溶液中水的电离程度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行一氯取代后,只能生成四种沸点不同的有机物,则该烷烃是( )
A.(CH3)2CHCH2CH2CH3B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2D.(CH3)3CCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌碘液流电池具有高电容量、对环境友好、不易燃等优点,可作为汽车的动力电源。该电池采用无毒ZnI2水溶液作电解质溶液,放电时将电解液储罐中的电解质溶液泵入电池,其装置如右图所示。下列说法不正确的是

A.M是阳离子交换膜
B.充电时,多孔石墨接外电源的正极
C.充电时,储罐中的电解液导电性不断增强
D.放电时,每消耗1molI3-,有1 molZn2+生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com