
用NA表示阿伏加德罗常数,下列说法正确的是
A.用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA
B.46g NO2和N2O4的混合气体中含N原子总数为NA
C.标准状况下,5.6L CCl4含有的分子数为0.25NA
D.等物质的量的NH4+和OH-含电子数均为10NA
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
下列物质中,既能跟强酸溶液反应,又能跟强碱溶液反应,并且生成物只是盐和水的是( )
A. Al(OH)3 B. Al C. NaHCO3 D. Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
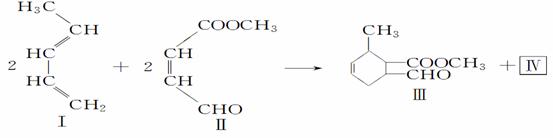
Ⅰ是重要的化工原料 ,可发生下列反应生成Ⅲ和Ⅳ。
,可发生下列反应生成Ⅲ和Ⅳ。
 |
(1)a的结构简式是________________;②的反应类型是____________。
(2)用甲醇与某有机物发生酯化反应可合成化合物Ⅱ,写出该反应的化学方程式______________________________________________________________。
(3)化合物Ⅱ与新制的氢氧化铜悬浊液反应的化学反应方程式为__________。
(4)化合物Ⅳ是Ⅲ的同分异构 体,也有同样的六元环,Ⅳ的结构简式为_____。
体,也有同样的六元环,Ⅳ的结构简式为_____。

(1)A、C的结构简式分别是_____________、__________。
(2)加热条件下,C在足量NaOH水溶液中反应的化学方程式是____________。
(3)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式:____________________________________________。
①能发生银镜反应
②一定条件下可发生水解反应
③分子的核磁共振氢谱中有四组峰]
(4)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方程式: _____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2010年4月中旬全球核安全峰会在华盛顿举行,发展核电、制裁核武器发展是会议主题,各式各样电池的发展是化学对人类的一项重大贡献,下列有关电池的叙述正确的是
A.手机上用的锂离子电池属于一次电池
B.锌锰干电池中,锌电极是负极
C.氢氧燃料电池工作时氢气在负极被还原
D.太阳能电池的主要材料为二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某有机物C6H12O2能发生水解反应生成A和B,B能氧化成C,若A、C都能发生银镜反应,则C6H12O2符合条件的结构简式有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是
①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质
A.②④ B.②③④ C.①③⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
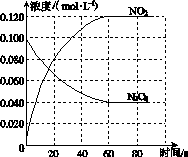
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com