
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )
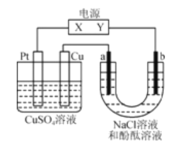
A. X极是电源负极,Y极是电源正极
B. a极的电极反应式为2Cl--2e-=Cl2
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Cu电极上增重6.4g时,b极产生4.48L(标准状况)气体
科目:高中化学 来源: 题型:
【题目】在卢瑟福粒子散射实验中,有少数粒子发生大角度偏转,其原因是
A. 原子中存在着带负电的电子
B. 正电荷在原子中是均匀分布的
C. 原子只能处于一系列不连续的能量状态中
D. 原子的正电荷和绝大部分质量都集中在一个很小的核里
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Fe(OH)3胶体的制备方法为:将_____________逐滴滴入_______中,继续加热煮沸,直至分散系呈现______。判断是否有胶体生成的方法是利用_______效应。
(2)硫化氢气体通入浓硫酸中发生反应:H2S + H2SO4(浓) === S↓ + SO2↑ + 2H2O
用单线桥法表示电子转移的方向和数目________________________,该反应的还原产物是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1mol化学键吸收的能量或形成1mol化学键释放的能量称为键能,部分物质的键能如下表所示:甲醛结构式为:![]() ,甲醛制备乌洛托品(C6H12N4)的反应如下,该反应的△H为( )
,甲醛制备乌洛托品(C6H12N4)的反应如下,该反应的△H为( )
6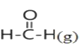 +4NH3(g)→
+4NH3(g)→ +6H2O(l)
+6H2O(l)
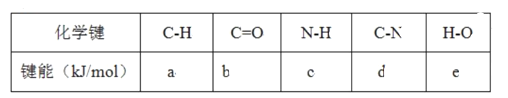
A. 6(a+b+c-d-e) kJ·mol-1B. 6(d+e-a-b-c) kJ·mol-1
C. 6(b+2c-2d-2e) kJ·mol-1D. 6(2d+2a+2e-b-3c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与硼(5B)同主族,与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素B.![]() 的中子数与电子数的差值为17
的中子数与电子数的差值为17
C.原子半径:In>AlD.碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为:xLi+Li1-xMn2O4 ![]() LiMn2O4,某手机镍氢电池总反应为: NiOOH+MH ==== M+Ni(OH)2(M为充电储氧金属或合金),有关上述两种电池的说法不正确的是( )
LiMn2O4,某手机镍氢电池总反应为: NiOOH+MH ==== M+Ni(OH)2(M为充电储氧金属或合金),有关上述两种电池的说法不正确的是( )
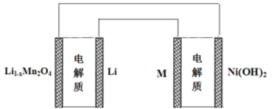
A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极的电极反应式NiOOH+H2O+e-Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式LiMn2O4-xe-=Li1-xMn2O4+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
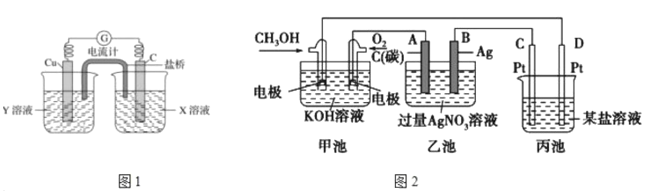
【题目】电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题:
(1)炒过菜的铁锅未及时洗浄(残液中含NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:铁锅的锈蚀应属于____________(填“析氢腐蚀”或“吸氧腐蚀”), 铁锅锈蚀的正极反应式为:____________。
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如上图1所示原电池,回答下列问题:
①写出正极电极反应式___________
②图中X溶液中的溶质是____________
(3)如图2是一个电化学反应的示意图。
①写出通入CH3OH的电极的电极反应式_______________
②乙池中总反应的离子方程式_____________
③熔融盐CH3OH燃料电池用熔融碳酸钾为电解质,则电池负极反应式__________
④当乙池中B(Ag)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液H+的浓度是_____________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是_____(填序号)。
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O。下列说法正确的是( )
A.O2和S2O32-是氧化剂,Fe2+是还原剂
B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1molFe3O4,转移电子的物质的量为2mol
D.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com