
| A��Na��(g)��Cl��(g)�D��NaCl(s)����Q |
| B��Na(s)��Cl2(g)�D��NaCl(s)����Q1 |
| C��Na(s)�D��Na(g)����Q2 |
| D��Na(g)��e���D��Na��(g)����Q3 |
 ??cC(g)��dD(g)��ȡa mol A��b mol B����V L�ܱ������У�2 min���������A��Ũ��Ϊx mol��L��1��������C��Ũ�ȱ仯����ʾ���ʱ���ڷ�Ӧ��ƽ������ӦΪ__________ __��
??cC(g)��dD(g)��ȡa mol A��b mol B����V L�ܱ������У�2 min���������A��Ũ��Ϊx mol��L��1��������C��Ũ�ȱ仯����ʾ���ʱ���ڷ�Ӧ��ƽ������ӦΪ__________ __�� ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
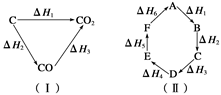
| A����H1+��H6=��H2+��H3+��H4+��H5 |
| B��A�D��D����H=��H1+��H2+��H3 |
| C��A�D��F����H=����H6 |
| D����H1+��H2+��H3+��H4+��H5+��H6=0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
| ����/kJ��mol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
 Si��s����4HCl��g�����÷�Ӧ�ķ�Ӧ
Si��s����4HCl��g�����÷�Ӧ�ķ�Ӧ �ȡ�HΪ ��������
�ȡ�HΪ ��������| A����412 kJ��mol��1 | B����412 kJ��mol��1 |
| C����236 kJ��mol��1 | D����236 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ʵ������������������ֱ���ȫȼ�գ����߷ų������� |
| B���ɵ���Aת��Ϊ����B��һ�����ȹ��̣��ɴ˿�֪����B�ȵ���A�ȶ� |
| C��ϡ��Һ�У�H����aq����OH����aq��=H2O��l������H����57.3kJ��mol��������0.5molH2SO4��Ũ�����뺬l mol NaOH����Һ��ϣ��ų�����������57.3kJ |
| D����25��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������H2ȼ���ȵ��Ȼ�ѧ����ʽΪ:2H2��g����O2��g����2H2O��l������H����571.6kJ��mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ҫ���ȵĻ�ѧ��Ӧ�������ȷ�Ӧ |
| B����ѧ��Ӧ�������������ʣ��������������ı仯 |
| C������Ӧ������������������������������÷�Ӧ��Ϊ���ȷ�Ӧ |
| D���ڻ�ѧ��Ӧ�У��Ͽ���ѧ��Ҫ�����������γɻ�ѧ��Ҫ�ų����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
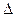 H=��570 kJ��mol-1��
H=��570 kJ��mol-1��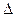 H="-242" kJ��mol-1
H="-242" kJ��mol-1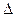 H= ��110.5 kJ��mol-1
H= ��110.5 kJ��mol-1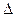 H=-393.5 kJ��mol-1
H=-393.5 kJ��mol-1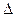 H= +890 kJ��mol-1
H= +890 kJ��mol-1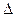 H="a" kJ��mol-1����a= ���÷�Ӧ����
H="a" kJ��mol-1����a= ���÷�Ӧ����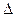 S 0(ѡ���������=����������)��
S 0(ѡ���������=����������)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2mol H2��ȫȼ������ˮʱ�ų�571.6 kJ������ |
| B��1mol Һ̬ˮ��ȫ�ֽ�����H2��O2ʱ�ų�285.8kJ������ |
| C��2������Ӻ�1����������ȫȼ������Һ̬ˮʱ�ų�571.6 kJ������ |
D�������Ȼ�ѧ����ʽ�ɱ�ʾΪH2(g)+ 1/2O2(g)��H 2O (1)����H��-285.8 kJ��mol-1 2O (1)����H��-285.8 kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��2H2(g)+ O 2(g) = 2H2O(1)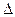 H = ��142.9kJ��mol��l H = ��142.9kJ��mol��l |
B��2H2(g)+ O 2(g) = 2H2O(1)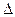 H = ��571.6kJ��mol��l H = ��571.6kJ��mol��l |
C��2H2+O2 = 2H2O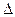 H = ��571.6lkJ��mol��l H = ��571.6lkJ��mol��l |
D��H2(g)+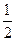 O 2(g) = H2O(1) O 2(g) = H2O(1)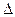 H = +285.8kJ��mol��l H = +285.8kJ��mol��l |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com