
����Ŀ��ijѧ���������ʵ��װ�������Ʊ�������Cl2��
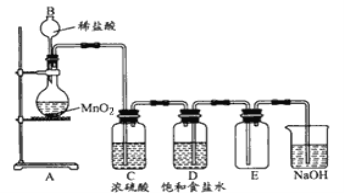
(1)װ�������崦������ָ��
��_______________
��_______________
��____________________
��_______________________
��_______________________
(2)�ڸ������װ��ͼ�У�ϴ��ƿ���������壩�еı���ʳ��ˮ��Ũ���ᡢ����������Һ�����÷ֱ��ǣ� �ٱ���ʳ��ˮ�����ã�__________��Ũ��������ã�_________�����������Ƶ����ã�_____________
(3)��8.7gMnO2�뺬14.6gHCl��Ũ���Ṳ����Cl2,��ͬѧ��Ϊ���Ƶ�7.1gCl2,��ͬѧ��Ϊ�Ƶ�Cl2������С��7.1g������Ϊ_____ ��������������������ͬѧ��ȷ��������________
���𰸡�����̨���پƾ��� Ӧ��Ũ���� D��Ӧ��Ϊ�����ܽ����̵��ܳ� ����©������ӦΪ��Һ©�� CDװ������˳���� ��ȥ�����е��Ȼ������� ��ȥ�����е�ˮ���� ���ն������������ֹ��Ⱦ���� �� �������̺�HCl�����ʵ���֮��Ϊ1:4���ӷ�Ӧ����ʽ������ǡ����ȫ��Ӧ�������ŷ�Ӧ�Ľ��У�Ũ���ᷴӦһ��ʱ���Ϊϡ���ᣬ�Ͷ������̲���Ӧ
��������
(1)ʵ������Ũ��������������ڼ��������·�����Ӧ�Ʊ�������Ũ�����ӷ����Ʊ��������к����Ȼ��⡢ˮ�������ʣ�����ͨ������ʳ��ˮ��Ũ�����ϴ��ƿ�Ⱥ��ȥ�Ȼ����ˮ��ע��ϴ��ƿϴ��Ӧ�����̳��������ܶȴ���ˮ��Ӧ���������ſ������ռ���β������װ����ӦΪ����������
(2)�ڸ������װ��ͼ�У�ϴ��ƿ(��������)�еı���ʳ��ˮ��Ũ���ᡢ����������Һ�����÷ֱ��dz�ȥ�����е��Ȼ��⡢ˮ����������ʣ�����������ã�
(3)���ŷ�Ӧ�Ľ��У�����Ũ�ȼ�С��ϡ������������̲���Ӧ��
(1)ʵ������Ũ��������������ڼ��������·�����Ӧ�Ʊ�������Ũ�����ӷ����Ʊ��������к����Ȼ��⡢ˮ������־������ͨ������ʳ��ˮ��Ũ�����ϴ��ƿ�Ⱥ��ȥ�Ȼ����ˮ��ע��ϴ��ƿϴ��Ӧ�����̳��������ܶȴ���ˮ��Ӧ���������ſ������ռ���β������װ����ӦΪ����������ͼ����������֮��Ϊ��������̨���پƾ��ƣ���Ӧ��Ũ��� ��D��Ӧ��Ϊ�����ܽ����̵��ܳ��� �ܳ���©������ӦΪ��Һ©���� ��CDװ������˳���ˣ�
(2)�ڸ������װ��ͼ�У�ϴ��ƿ(��������)�еı���ʳ��ˮ��Ũ���ᡢ����������Һ�����÷ֱ��ǣ��ٱ���ʳ��ˮ�����ã���ȥ�����е��Ȼ������壬��Ũ��������ã���ȥ�����е�ˮ���������������Ƶ����������ն������������ֹ��Ⱦ������
(3)���ŷ�Ӧ�Ľ��У�����Ũ�ȼ�С��ϡ������������̲���Ӧ�������ɵ���������С��7.1g����ͬѧ��˵����ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д�����л��ţ�������ţ������ƻ�ṹ��ʽ��
��CH2CH3_______����Br_______��̼̼������_______����������
��2����ϩ�Ŀռ乹�͡�_______����������
��3����Ȳ�ĵ���ʽ_______������������
��4������ͬϵ���ͨʽ_______������������
��5��![]() ����ʽ��_______������������
����ʽ��_______������������
��6��![]() �䱽���ϵ�һ�ȴ�����_______����
�䱽���ϵ�һ�ȴ�����_______����
��7��2��5��������4���һ����飨д���ṹ��ʽ����_______����������
��8��4��4��5��������2����Ȳ��д���ṹ��ʽ����_______����������
��9��![]() ��ϵͳ������_______������������
��ϵͳ������_______������������
��10��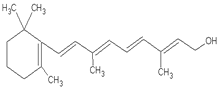 1mol����������_______molH2��_______molBr2����_______molNa
1mol����������_______molH2��_______molBr2����_______molNa
��11�����𱽣��⻯����Һ����������Һ����ϩ�����Ȼ�̼ʱ��ֻ����һ���Լ������Լ���_____��
��12��д��C5H8����Ȳ��������ͬ���칹��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L���ܱ������м���1molX��0.3molZ��һ������Y�������塣һ�������·�����Ӧ�������ʵ�Ũ����ʱ��ı仯��ͼ����ʾ��ͼ��Ϊt2ʱ�̺�ı䷴Ӧ������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ����ı�һ�ֲ�ͬ������������˵������ȷ����
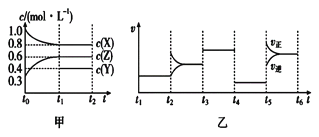
A. Y����ʼ���ʵ���Ϊ0.5mol
B. �÷�Ӧ�Ļ�ѧ����ʽΪ2X(g)��Y(g)![]() 3Z(g) ��H<0
3Z(g) ��H<0
C. ��t0 =0��t1=10s����t0��t1�ε�ƽ����Ӧ����Ϊv(Z)=0.03mol��L��1��s��1
D. ��Ӧ��X��ת����t6���t3���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƶĺ����������˵����ȷ����
A. 7.8 g Na2O2�����к���������Ϊ0.3NA
B. Na2O2��Na2O���Ԫ����ͬ����CO2��Ӧ����Ҳ��ͬ
C. Na2O2��H2O��Ӧʱ��H2O����ԭ��
D. �����ơ��������ƾ�Ϊ���ӻ�����������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C���������о�����ͬһ��Ԫ��M������֮������ͼ��ʾ��ת����ϵ��AΪһ�ֽ������ʣ������ֱ�ӹ�ϵ������������Ӧ�٢ڢ۾�Ϊ���Ϸ�Ӧ����Ӧ��Ϊ�û���Ӧ�������й�˵���������
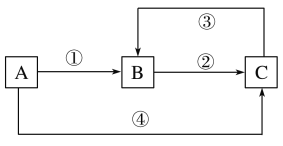
A. ���������Լ�����������
B. ������Ҫ�Ӿ��������Ե��Լ�
C. Ԫ��M�ڢ��з����ļ�̬�仯Ҳ��ͨ���ӵ⻯����Һʵ��
D. A��ϡ���ᷴӦһ����ʵ��Ԫ��M�ڢ��з����ļ�̬�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������1����ѧϰ����A���ˡ�B�������ᾧ����C����D��Һ��E��ȡ��F����һ�����ʵ���Ũ�ȵ���Һ��������ѧ��֪ʶ�ش������������⣺
��1��ѡ���ʵ��ķ���������ᴿ��Ӧѡ��������һ�֣�������ţ�
�ٳ�ȥ NaCl ��Һ������������ KNO3__________��
�ڴӵ�ˮ����ȡ��__________��
��������ˮ��ȡ����ˮ__________��
�ܷ���ֲ���ͺ�ˮ__________��
��2�������ˡ��������ᾧ�����_____ʵ���õ��˲���������Ҫ���ȵ�ʵ�����������ᾧ����__________������ţ���
��3��ͼ�������Լ�ƿ��ǩ�ϵ����ݡ�ʵ�����ø���������240mL0.46mol/L��ϡ���ᣬ��

a.����ȡ����������Ϊ__________mL��
b.���������������ձ� ��100mL��Ͳ ��250mL����ƿ��500mL����ƿ �ݲ����� ��������ƽ�������룩��10mL��Ͳ�ེͷ�ιܣ����ƹ����У�����ʹ�õ�������_____������ţ���
��4����ͬѧʵ�����Ƶõ���Ũ��Ϊ0.47mol/L�����ܵ�ԭ����_______________
A����ȡŨH2SO4ʱ���ӿ̶� B������ƿϴ����δ�����ﴦ��
C��û�н�ϴ��Һת������ƿ D������ʱ���ӿ̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҺX�п��ܺ������������е������֣�Cl-��![]() ��
��![]() ��
��![]() ��Na+��Mg2+��Fe3+��Ϊ��ȷ������Һ����ɣ�ijͬѧȡ100mL������ҺX������������ʵ�飨��Ҫʱ�ɼ��ȣ�������˵������ȷ����
��Na+��Mg2+��Fe3+��Ϊ��ȷ������Һ����ɣ�ijͬѧȡ100mL������ҺX������������ʵ�飨��Ҫʱ�ɼ��ȣ�������˵������ȷ����
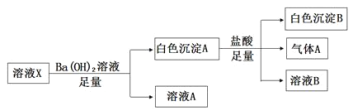
A.����A������CO2��SO2
B.��ҺX��һ������![]()
C.��ҺX��һ��������Fe3+��Mg2+�����ܴ���Na+
D.����ҺA���������ữ����������Һ�������ɰ�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��10mLij��̬ϩ����50mLO2����ȼ�գ��õ�Һ̬ˮ�����Ϊ35mL�Ļ�����壨ͬ��ͬѹ�²ⶨ��������̬ϩ���ǣ� ��
A. ��ϩB. ��ϩC. 1-��ϩD. 2-��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����������һ�����ʵ���Ũ�ȵ� NaOH��Һ����ش�
��1��������ƿ�ϲ����ֵı�ʶ��___����д��ĸ����ͬ��
A���ݻ� B��ѹǿ C���¶� D���ܶ� E���̶���
������ƿ���߱��Ĺ�����___��
A.���Գ����������ƺõ���Һ B.�������������ܽ��������
C.�������������巢��װ�� D.����һ�����ȷŨ�ȵı���Һ
��2���� NaOH��������480mL1mol��L-1NaOH��Һ����������ƽ��ȡ___gNaOH���塣��ͼΪ���ƹ��̵�ijһ���������ò���������___��
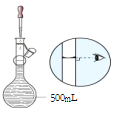
��3����ͬѧ������ 1mol��L-1NaOH��Һ���� 250mL0.1mol��L-1�� NaOH��Һ�����������в���Ҫ�õ�����___��
����ƽ ���ձ� ����Ͳ �ܲ����� ������ƿ ��ͷ�ι�
��4����ͬѧ�����������У����²���ʹ������Һ�����ʵ���Ũ��ƫ�����___��
A��ȡ��ȡ NaOH���壬���ܽ������ת�Ƶ� 100mL����ƿ�в�����
B�����ݲ�ҡ�ȣ�����ƿ��������Һ����ڿ̶��ߣ�����������ˮ����
C���������� 1mol��L-1NaOH��Һϴ�� 250mL����ƿ 2��3��
D��������ƿ�м�ˮ�������̶��ߣ��ý�ͷ�ι��������ٶ����� 100mL��
��5����������ƿ��ת����Һʱ��������Һ����������������___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com