
【题目】对甲烷和 CO2 的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合 CO2 重整反应有:
反应(i):2CH4(g)+O2(g)2CO(g)+4H2(g) △ H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)2CO(g)+2H2(g) △ H=+247.0 kJmol-1
(1)写出表示 CO 燃烧热的热化学方程式:_____。
(2)在两个体积均为 2L 的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如表所示:
容器 | 起始物质的量(n) / mol | CO2的平衡转化率 | |||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列条件能说明反应达到平衡状态的是_____。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②达到平衡时,容器Ⅰ、Ⅱ内 CO 的物质的量的关系满足:2n(CO)Ⅰ_____n(CO)Ⅱ(填“>”、“=”或“<”)
(3)将一定量的甲烷和氧气混合完成反应(i),其他条件相同,在甲、乙两种不同催化剂作用下, 相同时间内测得 CH4 转化率与温度变化关系如图所示。c 点_____(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____。

(4)CO2 也可通过催化加氢合成乙醇,其反应原理为:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) H<0。设 m 为起始时的投料比,即 m= n(H2)/ n(CO2)。通过实验得到下列图象:
图1 图2
图2 图3
图3
①图 1 中投料比相同,温度从高到低的顺序为_________。
②图 2 中 m1、m2、m3 从大到小的顺序为_________。
③图 3 表示在总压为 5 MPa 的恒压条件下,且 m=3 时,平衡状态时各物质的物质的量分数与温度的关系。T4 温度时,该反应压强平衡常数KP的计算式为_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
【答案】CO(g)+![]() O2(g)=CO2(g) △ H=-282.7kJmol-1 C > 一定未 催化剂不会影响平衡转化率,在相同条件下,乙催化剂对应的 c 点的转化率没有甲催化剂对应的 b 点的转化率高,所以 c 点一定未平衡 T3>T2>T1 m1>m2>m3
O2(g)=CO2(g) △ H=-282.7kJmol-1 C > 一定未 催化剂不会影响平衡转化率,在相同条件下,乙催化剂对应的 c 点的转化率没有甲催化剂对应的 b 点的转化率高,所以 c 点一定未平衡 T3>T2>T1 m1>m2>m3 ![]()
【解析】
(1)书写燃烧热的热化学方程式,一定要保证:可燃物的化学计量系数为1;可燃物发生完全燃烧;生成产物是在常温常压下稳定存在的物质,根据盖斯定律可得:![]()
![]() ;
;
(2) ①A.2v正(CH4) =v逆(CO)时,反应才达到平衡状态,A项错误;
B.由于平衡常数未知,所以浓度满足上式不一定处于平衡状态,B项错误;
C.由于该反应是在恒温恒容条件下进行的,且属于非等体积反应,根据公式![]() 可知,当压强不变,该反应一定达到平衡,C项正确;
可知,当压强不变,该反应一定达到平衡,C项正确;
D.由于该反应是在恒温恒容条件下进行的,且全为气体参与,根据公式![]() 可知,密度恒定与平衡状态无关,D项错误;
可知,密度恒定与平衡状态无关,D项错误;
答案选C。
②构造容器Ⅲ:除起始物质只加入0.2molCH4和0.2molCO2外,其他条件与Ⅰ、Ⅱ相同;通过分析可知容器Ⅱ、Ⅲ中的平衡等效。容器Ⅲ相比于容器Ⅰ,进料增加了一倍,考虑到反应方程式,所以Ⅲ相比于Ⅰ,平衡逆移,CO的含量下降,所以2n(CO)Ⅰ>n(CO)Ⅱ;
(3)催化剂对于平衡无影响,相同条件下,加入甲催化剂达到的转化率b高于加入乙催化剂的转化率c,所以c点对应的一定不是平衡状态;
(4) ①由于该反应放热,所以温度越高反应物转化率越低,所以T3>T2>T1;
②对于两种反应物的反应,增加其中一种物质的投料,会使另一种物质的转化率提高,所以m1>m2>m3;
③由于投料按照化学计量系数比进行,所以反应任意时刻,n(H2):n(CO2)=3:1,且n(乙醇):n(水)=1:3;所以图中c线为H2,d线为CO2,a线为水,b线为乙醇;结合数据可知,T4时,平衡状态时,H2含量为0.375,CO2为0.125,水为0.375,乙醇为0.125。所以压强平衡常数的表达式为: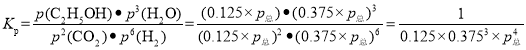 。
。


科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32—水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 纯碱溶液呈碱性的原因是CO32—+H2O![]() HCO3—+OH-
HCO3—+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素在农业、医药等诸多领域应用广泛。工业上有多种工艺用NH3和CO2直接合成尿素。
(1)水溶液全循环法合成尿素的反应过程可用下列热化学方程式表示:
反应I 2NH3(1) +CO2(g)NH2 COONH4(1) △H1 = - 119.2 kJmol-1
反应II NH2COONH4(1)CO(NH2)2(1)+ H2O(1) △H2= 15.5 kJmol-1
①写出NH3(1)与CO2(g)反应生成CO(NH2)2(1)和液态水的热化学方程式:______。
②该工艺要求在190~ 200℃、13 ~ 24 MPa 的条件下反应,90℃左右反应可实现最高平衡转化率。试解释选择高压条件的理由:_________。
(2)在不同氨碳比L=![]() 和水碳比W=
和水碳比W=![]() 条件下CO2平衡转化率x随温度T变化情况如图所示:
条件下CO2平衡转化率x随温度T变化情况如图所示:

①CO2平衡转化率x随温度T升高先增大后减小,试分析原因:_________。
②在图中,画出L=4、W=O时CO2平衡转化率x随温度T变化的曲线示意图____。
(3)实验室模拟热气循环法合成尿素,T℃度时,将5.6mol NH3与5.2molCO2在容积恒定为0.5L的恒温密闭容器中发生反应:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O (g) △H1=—43kJmol-1。达到平衡状态时,NH3与CO2的平衡分压之比 p(NH3): p(CO2)= 2:13。[p(NH3)= x(NH3)p,x(NH3)为平衡体系中NH3的物质的量分数,p为平衡总压]。
①T ℃时,该反应的平衡常数 K = ______________。
②若不考虑副反应,对于该反应体系,下列说法正确的是 _________ 。
A.当反应体系中气体分子的平均摩尔质量保持不变时,反应达到平衡状态
B.相同条件下,提高水碳比或降低氨碳比都会使NH3 的平衡转化率降低
C.在容器中加入CaO,(可与 H2O反应),提高CO(NH2)2产率
D.反应开始后的一段时间内,适当升温可提高单位时间内CO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(1)请分析该反应中电子转移的情况(用双线桥表示)______。
(2)浓盐酸在反应中显示出来的性质是____(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若标准状况下产生4.48LCl2,被氧化的盐酸的物质的量为___mol,转移电子的物质的量_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )

A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如下:

下列说法不正确的是
A. 过程i发生了取代反应
B. 中间产物M的结构简式为![]()
C. 利用相同原理以及相同原料,也能合成间二甲苯
D. 该合成路线理论上碳原子100%利用,且最终得到的产物易分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,由对甲基苯酚(![]() )合成BHT的常用方法有2种(如图),下列说法不正确的是
)合成BHT的常用方法有2种(如图),下列说法不正确的是

A. BHT能使酸性KMnO4溶液褪色
B. BHT与对甲基苯酚互为同系物
C. BHT中加入浓溴水易发生取代反应
D. 方法一的原子利用率高于方法二
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,在化工、医药、农药等方面有广泛的应用。
I·甲醛的制备
工业上利用甲醇脱氢法制备甲醛,己知:CH3OH(g)![]() HCHO(g)+H2(g) △H
HCHO(g)+H2(g) △H
(1)该反应的能量变化如图甲所示,△H=___kJmol-1。
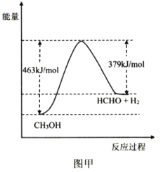
(2)为提高CH3OH转化率,采取的措施有___、___;在温恒容条件下,该反应达到平衡状态的标志有___(填标号)。
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.v(CH3OH)消耗=v(H2)生成
d.甲醛的浓度保持不变
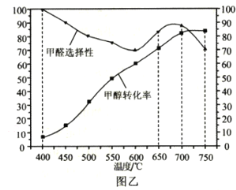
(3)选用Ag/SiO2—ZnO作催化剂,在400~750℃区间进行活性评价,图乙给出了甲醇转化率与甲醛选择性(选择性越大,表示生成该物质越多)随反应温度的变化曲线。制备甲醛的最佳反应温度为___(填标号),理由是___。
a.400℃ b.650℃ c.700℃ d.750℃
(4)T℃时,在2L恒容密闭容器中充入1mo1甲醇,发生反应:
①CH3OH(g)![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
②CH3OH(g)![]() CO(g)+2H2(g)
CO(g)+2H2(g)
平衡时甲醇为0.2mol,甲醛为0.7mo1。则反应i的平衡常数K=___。
II.甲醛的用途
(5)将甲醛水溶液与硫酸镍(NiSO4)溶液混合,可用于化学镀镍。反应过程中有CO2产生,则该反应的离子方程式为___:若收集到112mLCO2(标准状况),理论上转移电子___ mo1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是__________;用电子式表示A和E形成的化合物的形成过程 。
(2)A、 D 、E、 F离子半径由大到小的顺序为________________________________。
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是__________________;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是____________________。该反应为 反应。(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为 。
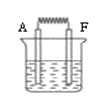
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为 ;外电路中电子从 电极流向 电极 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com