
【题目】某学习小组设计以下四个实验探究氯水的成分,请根据下表回答问题。
实验序号 | 实验方法 | 实验现象 | 结论 |
① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
② | 将氯水滴加到含有酚酞的NaOH溶液中 | ||
③ | 淀粉KI试纸变蓝色 | 氯水中含有Cl2 | |
④ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中含有H+ |
(1)实验①得出的结论__________________________________________。
(2)指出实验②和实验④中的“实验现象”:②_____________;④____________。
(3)实验③中“实验方法”的具体操作过程是:___________________________________。
(4)通过实验②的“实验现象”,同学们得出两个不同的结论。这两个结论可能是a_____________,b._________。请设计简单的实验证明哪一个是正确的_______。
【答案】 氯水中含有Cl- 溶液褪色 有气泡冒出 取一片淀粉KI试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上 氯水中含有HClO,其漂白作用使溶液褪色 氯水中含有H+,中和OH-使溶液褪色 向褪色后的溶液中滴加NaOH溶液至溶液显碱性,若溶液不再显红色,证明红色消失是HClO的漂白作用引起的;若溶液重新显红色,证明是H+的中和作用引起的
【解析】(1)加入硝酸银生成白色AgCl沉淀,可证明氯水中含有![]() ,因此,本题正确答案是:氯水中含有
,因此,本题正确答案是:氯水中含有![]() ;
;
(2)(2)氯水中含有盐酸,可与NaOH发生中和反应,含有次氯酸,具有强氧化性和漂白性,则可观察到溶液褪色;(4)氯水呈酸性,溶液中含有![]() ,加入
,加入![]() 溶液,生成二氧化碳气体,可观察到有气泡冒出,因此,本题正确答案是:溶液褪色;有气泡冒出;
溶液,生成二氧化碳气体,可观察到有气泡冒出,因此,本题正确答案是:溶液褪色;有气泡冒出;
(3)检验氯水中含有![]() ,可将氯水滴在淀粉
,可将氯水滴在淀粉![]() 试纸上没具体操作为取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上,因此,本题正确答案是:取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上;
试纸上没具体操作为取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上,因此,本题正确答案是:取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上;
(4)氯水中含有盐酸,可与NaOH发生中和反应,含有次氯酸,具有强氧化性和漂白性,都可使溶液褪色,则两种可能情况为:a为氯水加入到NaOH溶液中发生了中和反应而使溶液褪色,b为氯水中含有次氯酸就有漂白性而使溶液褪色,要验证结论的正误,可向褪色后的溶液中加NaOH溶液至碱性,溶液变红,可证明a正确,不再显红色,证明b正确,
因此,本题正确答案是:氯水加入到NaOH溶液中发生了中和反应而使溶液褪色;氯水中含有次氯酸就有漂白性而使溶液褪色;向褪色后的溶液中加NaOH溶液至碱性,溶液变红,可证明a正确,不再显红色,证明b正确;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:

请根据操作流程回答下列问题:
(1)操作①在加热时应选择_________盛装混合物(填仪器名称)。
(2)进行操作②后,判断SO42-已沉淀完全的方法是_________。
(3)操作③的离子方程式为_________。
(4)操作④的目的是_________。
(5)实验室进行操作⑤的具体步骤是_________。
(6)某同学欲用制得的氯化钠固体配制100mL0.2mol·L-1的氯化钠溶液。
①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_________。
②下列操作会使所配氯化钠溶液浓度偏小的是_________(请填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后发现凹液面低于刻度线又加水补上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的使用,下列操作正确的是( )
A.使用前要先检查容量瓶是否漏液
B.用蒸馏水洗涤后必须要将容量瓶烘干
C.为了方便快捷,可以直接在容量瓶内进行固体溶解
D.定容结束后,为了使溶液均匀,手握瓶颈,左右振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含砷(As )的有毒工业废水经如下图流程转化为粗Aa2O3。已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
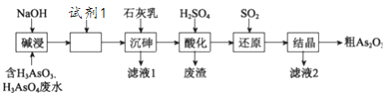
(1)加入试剂1的目的是:_________________________。
(2)“沉砷”是将砷元素转化为Ca5(AsO4)3OH 沉淀,发生的主要反应有:
A.Ca(OH)2(s) ![]() Ca2+(aq) + 2OH-(aq) ΔH <0
Ca2+(aq) + 2OH-(aq) ΔH <0
B.5Ca2+ + OH-+ 3AsO43-![]() Ca5(AsO4)3OH ΔH >0
Ca5(AsO4)3OH ΔH >0
研究表明:“沉砷”的最佳温度是85℃, 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是________。
(3)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是________。
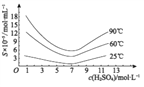
(4)通过对H3AsO3溶液进行_____(填操作名称),再过滤可制得粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如下图所示。为控制滤液2 中As2O3的浓度不高于6×10-5 mol·L-1 ,则“结晶”过程应控制的条件是______________________(例举一例回答)
(5)从绿色化学和综合利用的角度考虑,对滤液2 处理方法是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,几种酸的电离平衡常数如下表所示。
序号 | ① | ② | ③ | ④ |
酸 | HF | CH3COOH | H2SeO4 | H2CO3 |
Ka1 | 6.4×10-4 | 1.8×10-5 | 完全电离 | 4.4×10-7 |
Ka2 | 1.0×10-2 | 4.7×10-11 |
(1)25℃时,pH=3 的盐酸V1mL与pH= 12 的氢氧化钠溶液V2mL混合后恰好成中性,则V1:V2=____:___。
(2)25℃时,0.1mol·L-1 HF 溶液的 c(H+)约为______mol·L-1 。将pH均3 的①、②、③溶液分别加水稀释至原来的10 倍,溶液的pH 大小关系:_____ (填序号)。
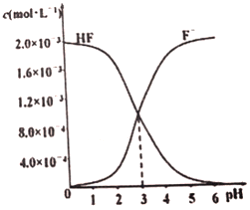
(3)在T℃时调节2.0×10-3mol·L-1 的氢氟酸水溶液的pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH 的关系如图所示。则HF 电离平衡常数为Ka(HF)=_________。
(4)向H2SeO4 溶液中滴加少量氨水,反应的离子方程式为___________________________。若将一定浓度的KHCO3 和KHSeO4两溶液混合,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2(s)+ C(s)+ N2(g)![]() Si3N4(s)+ CO(g)
Si3N4(s)+ CO(g)
(1)配平反应中各物质的化学计量数______,已知生成1 mol氮化硅(Si3N4)放出1 591.2 kJ的热量,该反应每转移1 mol e-,放出______kJ的热量。
(2)该反应的平衡常数表达式为K=____。升高温度,其平衡常数______(选填“增大”“减小”或“不变”)。
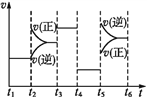
(3)该化学反应速率与反应时间的关系如上图所示,t2时引起v(正)突变、v(逆)渐变的原因是_________,t3引起变化的因素为_________,t5时引起v(逆)大变化、v(正)小变化的原因是_________。
(4)利用右图装置,可以模拟铁的电化学防护。
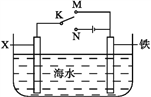
若X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学防护法称为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.钾的金属性比钠强
B.溴的非金属性比氯强
C.ⅦA族中原子半径最小的是氟
D.第三周期中,除稀有气体元素外原子半径最大的是钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以丙烯为原料合成抗炎药物D 和机体免疫增强制剂I的合成路线如下(部分反应条件和产物已经略去):
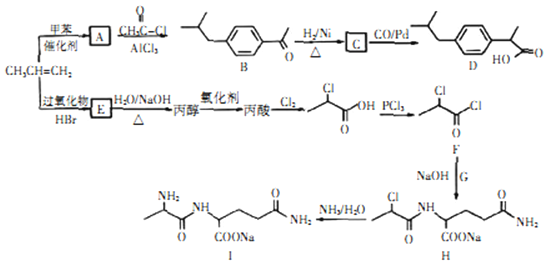
请回答下列问题:
(1)由丙烯生成E的反应类型为_______,E 的结构简式为_______。
(2)D 中的官能团名称为_______ 。
(3)化合物G 的化学式为C5H10O3N2,则其结构简式为_______。
(4)写出E生成丙醇的化学反应方程式_______ 。
(5)A的同分异构体中属于苯的同系物的共有_______种(不包含A),其中核磁共振氢谱有四组峰的是_______(写一种结构简式)。
(6)已知: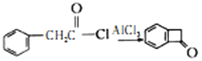 。结合上述流程的信息,设计由
。结合上述流程的信息,设计由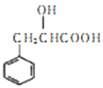 制备
制备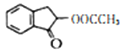 的合成路线_______________。
的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有6.02×1024个CO2,这些分子的物质的量是________mol,这些分子的质量是_______g,这些分子在标准状况下的体积是____________升,其中氧原子的个数是_____________个(NA可取6.02×1023mol-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com