
【题目】已知25℃时,几种酸的电离平衡常数如下表所示。
序号 | ① | ② | ③ | ④ |
酸 | HF | CH3COOH | H2SeO4 | H2CO3 |
Ka1 | 6.4×10-4 | 1.8×10-5 | 完全电离 | 4.4×10-7 |
Ka2 | 1.0×10-2 | 4.7×10-11 |
(1)25℃时,pH=3 的盐酸V1mL与pH= 12 的氢氧化钠溶液V2mL混合后恰好成中性,则V1:V2=____:___。
(2)25℃时,0.1mol·L-1 HF 溶液的 c(H+)约为______mol·L-1 。将pH均3 的①、②、③溶液分别加水稀释至原来的10 倍,溶液的pH 大小关系:_____ (填序号)。
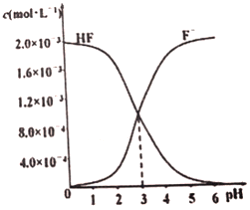
(3)在T℃时调节2.0×10-3mol·L-1 的氢氟酸水溶液的pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH 的关系如图所示。则HF 电离平衡常数为Ka(HF)=_________。
(4)向H2SeO4 溶液中滴加少量氨水,反应的离子方程式为___________________________。若将一定浓度的KHCO3 和KHSeO4两溶液混合,反应的离子方程式为_________________________。
【答案】 10 1 8.0×10—3 ③>①>② 1.0×10—3 NH3·H2O+H+=NH4+ +H2O HCO3—+ HSeO4—=SeO42—+H2O+CO2↑
【解析】(1)25℃时,V1mLpH=3的盐酸与V2mLpH=12的氢氧化钠溶液混合后恰好成中性,说明二者恰好完全反应,则0.001mol/L×V1×10-3L=0.01mol/L×V2×10-3L,解得:V1:V2=10:1,故答案为:10;1;
(2)根据题意知,HF的电离平衡常数为6.4×10-4,则6.4×10-4=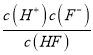 =
=![]() ,解得c(H+)=8.0×10—3 mol/L;根据电离常数可知,酸性H2SeO4>HF>1.8×10-5,则将pH均3的①、②、③溶液分别加水稀释至原来的10倍,酸性越强,pH变化越大,溶液的pH大小关系为③>①>②,故答案为:8.0×10—3;③>①>②;
,解得c(H+)=8.0×10—3 mol/L;根据电离常数可知,酸性H2SeO4>HF>1.8×10-5,则将pH均3的①、②、③溶液分别加水稀释至原来的10倍,酸性越强,pH变化越大,溶液的pH大小关系为③>①>②,故答案为:8.0×10—3;③>①>②;
(3)由图象可知,当pH=3时,c(F-)=c(HF),则Ka(HF)= 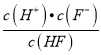 = c(H+)=1.0×10—3,故答案为:1.0×10-3;
= c(H+)=1.0×10—3,故答案为:1.0×10-3;
(4) H2SeO4溶液中滴加少量氨水反应生成酸式盐,由于H2SeO4的一级电离完全电离,反应的离子方程式为NH3·H2O+H+=NH4+ +H2O。由于H2SeO4的二级电离部分电离,将一定浓度的KHCO3和KHSeO4两溶液混合反应生成二氧化碳,反应的离子方程式为HCO3—+ HSeO4—=SeO42—+H2O+CO2↑,故答案为:NH3·H2O+H+=NH4+ +H2O;HCO3—+ HSeO4—=SeO42—+H2O+CO2↑。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】晋朝人常璩在《华阳国志》里有这样一段话:临邛县“有火井,夜时光映上昭。民欲其火,先以家火投之。顷许如雷声,火焰出,通耀数十里。以竹筒盛其火藏之,可拽行终日不灭也……”,请回答下列问题。
(1)话中描述的物质是一种最简单有机物甲烷,其分子的结构式为_______。
(2)写出“顷许如雷声,火焰出”涉及的化学反应方程式:_____________________。
(3)下列有关甲烷的说法正确的是________(填选项字母)。
A.它属于化石能源
B.它的分子中含有非极性键
C.它的分子中所有原子的最外层都达到了8电子稳定结构
D.(2)中反应发生时伴随有旧极性键的断裂和新极性键的形成
(4)甲烷不仅可以直接用来燃烧,还是重要的化工原料,它可以与水在高温条件下反应制得水煤气(CO和H2),反应的化学方程式为__________________,反应得到的水煤气中CO和H2的质量比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质①NaHCO3 ②(NH4)2SO4 ③Al2O3 ④(NH4)2CO3⑤Mg(OH)2中,既可以和盐酸反应也可以和Ba(OH)2溶液反应的是( )
A. ①③④ B. ①②③④ C. ②③④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素位于第三周期第ⅣA族.下列叙述不正确的是( )
A.该元素是金属元素
B.该元素原子的核电荷数为14
C.该元素原子核外有3个电子层
D.该元素原子不容易得到或者失去最外层电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为第IVA族具有可变价的金属元素,其单质沸点为2260℃。四氯化锡(SnCl4)是无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室中可用氯气与过量金属锡通过下图装置制备SnCl4 (夹持装置已略去)。
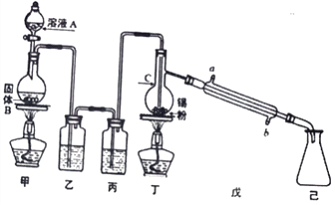
(1)仪器C的名称为___________,装置乙中的试剂是_____________。
(2)装置甲中发生反应的化学方程式为___________________________________。
(3)氯气与锡的反应类似与铁的反应,但该实验中对装置丁要持续加热,其原因是_____________。
(4)你认为该实验装置需要进行的改进是:__________________________________________。
(5)用下列方法和步骤测定所用金属锡样品的纯度(杂质不参加反应)
①将2.000g锡完全溶于过量稀盐酸中,并用所得溶液去还原过量的FeCl3稀溶液,最后得100.00mL 溶液。写出第二步反应的离子方程式:_____________________________。
②取①所得溶液amL用0.100 mol·L-1 的K2Cr2O7溶液滴定,发生如下反应:6FeCl2+ K2Cr2O7+ 14HCl=6FeCl3+2KCl+2CrCl3+7H2O。
K2Cr2O7溶液应注入到____式(填"酸或碱”) 滴定管中。到达滴定终点时用去bmL。则样品中锡的质量分数为_______%(用含a、b 的最简代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计以下四个实验探究氯水的成分,请根据下表回答问题。
实验序号 | 实验方法 | 实验现象 | 结论 |
① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
② | 将氯水滴加到含有酚酞的NaOH溶液中 | ||
③ | 淀粉KI试纸变蓝色 | 氯水中含有Cl2 | |
④ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中含有H+ |
(1)实验①得出的结论__________________________________________。
(2)指出实验②和实验④中的“实验现象”:②_____________;④____________。
(3)实验③中“实验方法”的具体操作过程是:___________________________________。
(4)通过实验②的“实验现象”,同学们得出两个不同的结论。这两个结论可能是a_____________,b._________。请设计简单的实验证明哪一个是正确的_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
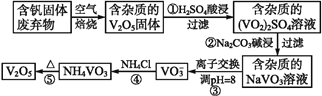
部分含钒化合物在水中的溶解性如下表:
物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有______。
(2)反应②碱浸后滤出的固体主要成分是______(写化学式)。
(3)反应④的离子方程式为__________。
(4)25 ℃、101 kPa时,4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)
2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)![]() 2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
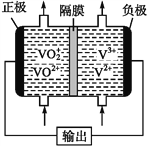
(5)钒液流电池(如下图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为_______,电池充电时阳极的电极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素同周期,且从左到右按原子序数的递增(原子序数为五个连续的自然数)的顺序排列如下:
![]()
下列说法正确的是
A. 若HnCOm为强酸,则D元素肯定是活泼的非金属元素
B. 若A(OH)n为强碱,则B(OH)m也一定为强碱
C. 若C的最高正化合价为+5价,则五种元素均为非金属元素
D. 若D的最低负化合价为-2价,则E的最高正价为+6价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脂肪烃CnHm分子中,碳碳原子间共用电子对数为(用含n、m的式子表示).若某脂肪烃分子中,碳碳原子间共有电子对数为28,且分子内含一个双键和一个叁键,则它的分子式为 . 若将Cn看做烃分子中的氢原子完全失去后的产物,则C60中碳碳原子间共用电对数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com