
【题目】某元素位于第三周期第ⅣA族.下列叙述不正确的是( )
A.该元素是金属元素
B.该元素原子的核电荷数为14
C.该元素原子核外有3个电子层
D.该元素原子不容易得到或者失去最外层电子
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2 并完成相关性质探究(不考虑水蒸气)。
(1)有同学认为制得的SO2 中可能混有杂质,其化学式为______和_________,原因是________。
(2)为验证气体成分,兴趣小组同学设计了下图所示装置进行了实验探究。
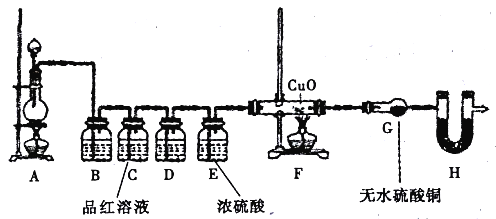
①为验证并吸收SO2,装置B 中加入的试剂为_____装置C中品红溶液的作用是_______;
②装置D中加入的试剂为____________;
③装置G中可能出现的现象为____________;
④装置H的作用为____________。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。
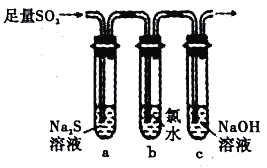
①能验证SO2 具有氧化性的实验现象为____________;
②为验证SO2 的还原性,取试管b 中充分反应后的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3 溶液,有白色沉淀生成
上述方案中合理的是____________(填“I”“ Ⅱ”或“Ⅲ”);试管b 中发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸毗醛素是细胞的重要组成部分,其结构式如下,下列有关叙述不正确的是

A. 该物质是一种磷酸酯类化合物
B. 该有机物能发生银镜反应
C. 该有机物可以发生取代、加成、氧化、还原、聚合反应
D. 1mol该有机物与NaOH溶液反应,最多消耗5mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的使用,下列操作正确的是( )
A.使用前要先检查容量瓶是否漏液
B.用蒸馏水洗涤后必须要将容量瓶烘干
C.为了方便快捷,可以直接在容量瓶内进行固体溶解
D.定容结束后,为了使溶液均匀,手握瓶颈,左右振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将HA和HB两种一元酸的溶液分别加水稀释,稀释时溶液pH的变化如图所示。则下列叙述中正确的是
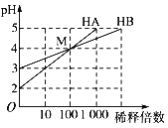
A. 稀释前,c(HA)=10c(HB)
B. 在M点两种溶液中水的电离程度相同
C. pH=a的0.1 mol·L-1HB溶液与pH=b0.01 mol·L-1HB溶液相比,a+1<b
D. 加水稀释HB溶液,HB的电离度增大,c(H+)/c(HB)减小,溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含砷(As )的有毒工业废水经如下图流程转化为粗Aa2O3。已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
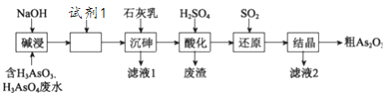
(1)加入试剂1的目的是:_________________________。
(2)“沉砷”是将砷元素转化为Ca5(AsO4)3OH 沉淀,发生的主要反应有:
A.Ca(OH)2(s) ![]() Ca2+(aq) + 2OH-(aq) ΔH <0
Ca2+(aq) + 2OH-(aq) ΔH <0
B.5Ca2+ + OH-+ 3AsO43-![]() Ca5(AsO4)3OH ΔH >0
Ca5(AsO4)3OH ΔH >0
研究表明:“沉砷”的最佳温度是85℃, 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是________。
(3)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是________。
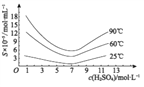
(4)通过对H3AsO3溶液进行_____(填操作名称),再过滤可制得粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如下图所示。为控制滤液2 中As2O3的浓度不高于6×10-5 mol·L-1 ,则“结晶”过程应控制的条件是______________________(例举一例回答)
(5)从绿色化学和综合利用的角度考虑,对滤液2 处理方法是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,几种酸的电离平衡常数如下表所示。
序号 | ① | ② | ③ | ④ |
酸 | HF | CH3COOH | H2SeO4 | H2CO3 |
Ka1 | 6.4×10-4 | 1.8×10-5 | 完全电离 | 4.4×10-7 |
Ka2 | 1.0×10-2 | 4.7×10-11 |
(1)25℃时,pH=3 的盐酸V1mL与pH= 12 的氢氧化钠溶液V2mL混合后恰好成中性,则V1:V2=____:___。
(2)25℃时,0.1mol·L-1 HF 溶液的 c(H+)约为______mol·L-1 。将pH均3 的①、②、③溶液分别加水稀释至原来的10 倍,溶液的pH 大小关系:_____ (填序号)。
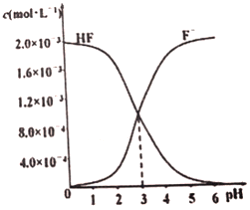
(3)在T℃时调节2.0×10-3mol·L-1 的氢氟酸水溶液的pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH 的关系如图所示。则HF 电离平衡常数为Ka(HF)=_________。
(4)向H2SeO4 溶液中滴加少量氨水,反应的离子方程式为___________________________。若将一定浓度的KHCO3 和KHSeO4两溶液混合,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.钾的金属性比钠强
B.溴的非金属性比氯强
C.ⅦA族中原子半径最小的是氟
D.第三周期中,除稀有气体元素外原子半径最大的是钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于卤素(用X表示)的叙述正确的是( )
A.其单质都能与水反应,通式为X2+H2O=HX+HXO
B.HX易溶于水,其水溶液都是强酸
C.其单质都有颜色,都有毒
D.最高价含氧酸的通式为HXO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com