
【题目】今有6.02×1024个CO2,这些分子的物质的量是________mol,这些分子的质量是_______g,这些分子在标准状况下的体积是____________升,其中氧原子的个数是_____________个(NA可取6.02×1023mol-1)。
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】某学习小组设计以下四个实验探究氯水的成分,请根据下表回答问题。
实验序号 | 实验方法 | 实验现象 | 结论 |
① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
② | 将氯水滴加到含有酚酞的NaOH溶液中 | ||
③ | 淀粉KI试纸变蓝色 | 氯水中含有Cl2 | |
④ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中含有H+ |
(1)实验①得出的结论__________________________________________。
(2)指出实验②和实验④中的“实验现象”:②_____________;④____________。
(3)实验③中“实验方法”的具体操作过程是:___________________________________。
(4)通过实验②的“实验现象”,同学们得出两个不同的结论。这两个结论可能是a_____________,b._________。请设计简单的实验证明哪一个是正确的_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
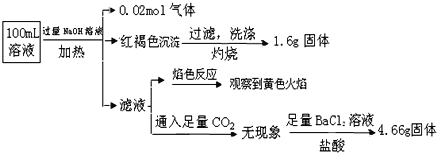
下列说法正确的是
A. 原溶液中c(Fe3+)=0.2mol/L
B. 溶液中至少有4种离子存在,其中Cl-一定存在
C. SO42-、NH4+、Na+一定存在,CO32-一定不存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脂肪烃CnHm分子中,碳碳原子间共用电子对数为(用含n、m的式子表示).若某脂肪烃分子中,碳碳原子间共有电子对数为28,且分子内含一个双键和一个叁键,则它的分子式为 . 若将Cn看做烃分子中的氢原子完全失去后的产物,则C60中碳碳原子间共用电对数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
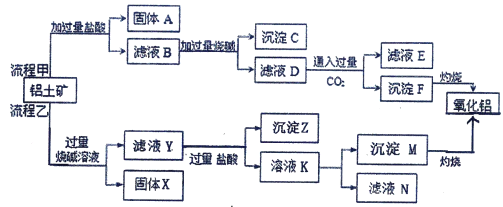
(1)流程甲中加入盐酸后生成Fe3+的离子方程式为________________;固体A是___________(填化学式),写出沉淀F转化为氧化铝的化学方程式是___________________________。
(2)流程乙中,向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是__________;固体X的主要用途有(写出1条即可) _____。沉淀Z为_______(填化学式)。由溶液K生成沉淀M的离子方程式是_________________________。
(3)流程乙中,将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol的镁、铝混合物溶于200mL4mol/LHCl溶液中,然后再滴加2mol/LNaOH溶液。
(1) 若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中n(Mg)=______mol,V2=______mL。
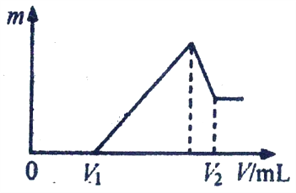
(2) 若在滴加NaOH 溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=______mL。
(3) 若混合物仍为0.2mol。其中Mg粉的物质的量分数为a,用200mL4mol/LHCl溶解此混合物后,再加入450mL2mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物能用相应元素的单质直接化合生成的是
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2 ⑦H2S ⑧FeCl3
A. ②③⑤⑦⑧ B. ①④⑥⑦ C. ①②③⑦⑧ D. ②③⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com