
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
【答案】(1) 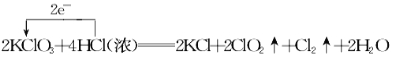 ;
;
(2)1:1;(3)2;(4)11.9;(5)2ClO2 + 2CN- = N2 + 2CO2 + 2Cl- ,50a/13 (或3.85a)。
【解析】
试题分析:(1)根据氧化还原反应的规律,KClO3中+5价Cl得电子转化成ClO2中+4价Cl,HCl中部分-1价Cl失电子转化成Cl2,2molKClO3参加反应共转移2×1mole-=2mol,因此单线桥表示电子转移的情况是: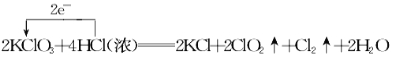 ;
;
(2)KClO3中Cl化合价降低,是养护剂,HCl一部分做还原剂,一部分显酸性,因此两者物质的量为1:1;
(3)根据(1)产生22.4LCl2转移2mole-;
(4)根据c=1000ρw/M,c(HCl)=1000×1.19×36.5%/36.5mol·L-1=11.9mol·L-1;(5)两种气体是N2和CO2,根据化合价的升降法进行配平,2ClO2+2CN-=N2+2CO2+2Cl-,根据离子反应反应方程式,n(ClO2)=n(CN-)=100×103×a×10-3/26mol=50a/13mol。


科目:高中化学 来源: 题型:
【题目】
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
⑴下列“鲜花保鲜剂”的成分中,属于非电解质的是 。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
⑵“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol.L-1。(只要求写表达式,不需要计算)
⑶配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、 、 。(在横线上填写所缺仪器的名称)
⑷在溶液配制过程中,下列操作正确且对配制结果没有影响的是 。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,有可逆反应:2A(g)+2B(g) ![]() C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
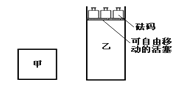
关于两容器中反应的说法正确的是( )
A.两容器达平衡后升高相同的温度时,甲容器的反应速率大于乙容器的速率
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的密度不同
C.甲容器中的反应先达到化学平衡状态
D.在甲容器中再充入2mol A和2 mol B,平衡后甲中物质C的物质的量是乙中物质C的物质的量的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚与乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列方法中不能对二者进行鉴别的是( )
A. 利用金属钠 B. 利用质谱法 C. 利用红外光谱法 D. 利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和CO2的混合气体36g,完全燃烧后测得CO2的体积为22.4 L(标准状况下)。
(1)求混合气体中CO的质量。
(2)混合气体中CO2在标准状况下的体积。
(3)混合气体在标准状况下的密度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)发射卫星的火箭推进器中大多使用燃料偏二甲肼,其化学式C2H8N2。用NA表示阿伏加德罗常数的数值,试计算:
①偏二甲肼的摩尔质量是____________。
②偏二甲肼中碳原子与氮原子物质的量之比是____________;1 mol偏二甲肼中含有的氢原子数目是________________。
(2)据报道,加利福尼亚大学的科研人员发现了世界上最强的酸。这种强酸的化学式是CHB11Cl11。其中l1个硼原子和1个碳原子排列成20面体,这是目前化合物中化学性质最为稳定的原子组合。请回答下列问题:
①这种超强酸由____________种元素组成。
②1mol该超强酸中含有的氯原子数目为___________,若称取该超强酸1049g,则其中含硼原子的数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,可逆反应2NO2![]() 2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2②混合气体的压强不再改变③混合气体的平均相对分子质量不再改变④单位时间内生成n mol O2,同时生成2n mol NO⑤混合气体的颜色不再改变⑥用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1.
A. ①④⑤⑥ B. ①②③⑤ C. ②③④⑥ D. 以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用铜作电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.Fe3O4与过量的稀HNO3反应: Fe3O4+8H+ Fe2++2Fe3++4H2O
C.向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至Ba2+刚好沉淀完全:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.NaHS溶液呈碱性:HS-+H2O![]() H3O++OH-+S2-
H3O++OH-+S2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com