
【题目】
A. C、H、0 B. C、H、0、P
C. C、H、0、N D. C、H、0、N、P
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将________(填“增大”、“减小”或“不变”)。
②下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1 000 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500 s内N2O5的分解速率为__________。
③在T2温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2________T1。
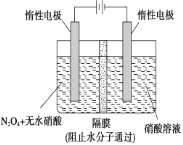
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的________区生成,其电极反应式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为____________mol
(2)该气体所含原子总数为____________个。
(3)该气体在标准状况下的体积为__________L
(4)该气体溶于1ml水中(不考虑反应),设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为_________mol· L-1。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)有以下几种物质① NaCl晶体 ②液态氯化氢 ③铜丝 ④SiO2 ⑤NH3 ⑥KNO3溶液 填空回答(填序号):以上物质中能导电的是 ;属于电解质的是 ;属于非电解质的是 ;上述纯净物中含有共价键的是 ;既不是电解质也不是非电解质的是 。
(2)A、B、C、D、E、F六种物质含有同一种元素,六种物质的相互转化关系如下,E是淡黄色粉末,判断:

写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
B→C:_________________________;E→B:________________________;
C→F:_________________________;F→C:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 乙醇、乙烷和乙酸都可以与钠反应生成氢气
B. 苯、乙醇和乙酸都能发生取代反应
C. 乙醇和乙酸都存在碳氧双键
D. 石油分馏可获得乙酸、苯及其同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质水解的说法不正确的是( )
A. 蛋白质水解的最终产物是多肽 B. 淀粉水解的最终产物是葡萄糖
C. 纤维素能水解成葡萄糖 D. 油脂水解产物之一是甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是_______;N2和H2的转化率比是_________。
(2)升高平衡体系的温度(保持体积不变),混和气体的平均相对分子质量__________,密度___________。(填“变大”、“变小”或“不变” )
(3)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减小一倍,平衡将向__________移动。
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将向_______________移动。
(5)若容器恒容,绝热、加热使容器内温度迅速升至原来的2倍,平衡将______________(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_____________(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为: 2KClO3 +4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________________。
(2)氧化剂与还原剂的物质的量之比是 ___________________
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 mol·L-1。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN- 等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN - 氧化,只生成两种气体,其离子反应方程式为为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
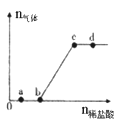
A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B.b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com