
【题目】在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是_______;N2和H2的转化率比是_________。
(2)升高平衡体系的温度(保持体积不变),混和气体的平均相对分子质量__________,密度___________。(填“变大”、“变小”或“不变” )
(3)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减小一倍,平衡将向__________移动。
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将向_______________移动。
(5)若容器恒容,绝热、加热使容器内温度迅速升至原来的2倍,平衡将______________(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_____________(填“大于”“小于”或“等于”)原来的2倍。
【答案】(1)1 : 3 ;1 : 1;
(2)变小;不变
(3)逆反应方向(或左);
(4)逆反应方向(或左)。
(5)向左移动;小于;
【解析】
试题分析:(1)依据起始量氮气和氢气物质的量之比等于反应之比分析判断,在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g),反应物起始量之比等于化学方程式中的反应之比,所以平衡浓度为1:3,N2和H2的转化率比是为1:1,故答案为:1:3;1:1;
2NH3(g),反应物起始量之比等于化学方程式中的反应之比,所以平衡浓度为1:3,N2和H2的转化率比是为1:1,故答案为:1:3;1:1;
(2)N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),反应是放热反应,升温平衡逆向进行,气体质量不变,物气体质的量增大,M=
2NH3(g)(正反应为放热反应),反应是放热反应,升温平衡逆向进行,气体质量不变,物气体质的量增大,M=![]() 可知,混和气体的平均相对分子质量减小;混合气体质量和体积不变,平衡后气体密度ρ=
可知,混和气体的平均相对分子质量减小;混合气体质量和体积不变,平衡后气体密度ρ=![]() ,所以密度不变;故答案为:变小;不变;
,所以密度不变;故答案为:变小;不变;
(3)当达到平衡时,将C(N2)、C(H2)、C(NH3)同时减小一倍,相当于压强减小,平衡逆向进行,故答案为:向逆反应方向;
(4)反应是气体体积减小的放热反应,恒温恒压容器加入氩气,为保持恒压体积增大,压强减小,平衡逆向进行,故答案为:向逆反应方向;
(5)升温,平衡向吸热方向移动,即向逆反应方向移动,使体系温度降低,故答案为:向左移动;小于。


科目:高中化学 来源: 题型:
【题目】下图为两个原电池装置图,由此判断下列说法错误的是( )

A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同
B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动
C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应
D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种溶液中,一定存在SO42- 的是( )
A.向甲溶液中加入Ba(NO3) 2溶液,产生白色沉淀
B.向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸,沉淀不溶解
C.向丙溶液中加入盐酸酸化,再加入BaCl2溶液,有白色沉淀产生
D.向丁溶液中加入硝酸酸化,再加入Ba(NO3)2溶液,有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.64 g SO2含有氧原子数为2NA
B.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C.标准状况下,22.4 L H2O的分子数为1NA
D.常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,有可逆反应:2A(g)+2B(g) ![]() C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
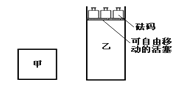
关于两容器中反应的说法正确的是( )
A.两容器达平衡后升高相同的温度时,甲容器的反应速率大于乙容器的速率
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的密度不同
C.甲容器中的反应先达到化学平衡状态
D.在甲容器中再充入2mol A和2 mol B,平衡后甲中物质C的物质的量是乙中物质C的物质的量的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚与乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列方法中不能对二者进行鉴别的是( )
A. 利用金属钠 B. 利用质谱法 C. 利用红外光谱法 D. 利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)发射卫星的火箭推进器中大多使用燃料偏二甲肼,其化学式C2H8N2。用NA表示阿伏加德罗常数的数值,试计算:
①偏二甲肼的摩尔质量是____________。
②偏二甲肼中碳原子与氮原子物质的量之比是____________;1 mol偏二甲肼中含有的氢原子数目是________________。
(2)据报道,加利福尼亚大学的科研人员发现了世界上最强的酸。这种强酸的化学式是CHB11Cl11。其中l1个硼原子和1个碳原子排列成20面体,这是目前化合物中化学性质最为稳定的原子组合。请回答下列问题:
①这种超强酸由____________种元素组成。
②1mol该超强酸中含有的氯原子数目为___________,若称取该超强酸1049g,则其中含硼原子的数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,请配平化学方程式:10Al+6NaNO3 + 4NaOH + 18H2O === 10 ________ + 3N2↑。若反应过程中转移5mol电子,则生成标况下的N2体积为________ L。
(二)化工生产盐酸的主要过程如图1所示:

其中关键的一步为图2所示的氯气和氢气在燃烧管口燃烧,生成HCl。氯气有毒,为防止污染大气,为此通入气体的合理方式是:A处通入_______,B处通入______;同时应采取的措施是___ __。
(三)已知氰(CN)2、硫氰(SCN)2和(OCN)2、ICl、BrCl的性质与卤素单质相似,故称它们为拟卤素。回答下列问题。
(1)写出硫氰(SCN)2的结构式 。
(2)(CN)2和KOH溶液反应的化学方程式为:______________。
(3)已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com