
【题目】(一)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,请配平化学方程式:10Al+6NaNO3 + 4NaOH + 18H2O === 10 ________ + 3N2↑。若反应过程中转移5mol电子,则生成标况下的N2体积为________ L。
(二)化工生产盐酸的主要过程如图1所示:

其中关键的一步为图2所示的氯气和氢气在燃烧管口燃烧,生成HCl。氯气有毒,为防止污染大气,为此通入气体的合理方式是:A处通入_______,B处通入______;同时应采取的措施是___ __。
(三)已知氰(CN)2、硫氰(SCN)2和(OCN)2、ICl、BrCl的性质与卤素单质相似,故称它们为拟卤素。回答下列问题。
(1)写出硫氰(SCN)2的结构式 。
(2)(CN)2和KOH溶液反应的化学方程式为:______________。
(3)已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________。
【答案】(一)Na[Al(OH)4](1分)11.2L(1分)
(二)H2(1分)Cl2(1分)先点燃H2,后通入Cl2(1分)
(三)(1)N≡C-S-S-C≡N(1分)
(2)(CN)2+2KOH=KCN+KCNO(或KOCN)+H2O(2分)
(3)(CN)2+2SCN-=2CN-+(SCN)2(2分)
【解析】
试题分析:(一)根据质量守恒,可知空格处为Na[Al(OH)4];反应中N的化合价从NaNO3中的+5价降低到N2中的0价,每生成1mol N2转移10mol电子,所以若反应过程中转移5mol电子,则生成标况下的N2体积为11.2L。
(二)氯气有毒,为使氯气完全反应,氢气应过量,所以A处通入氢气,B处通入氯气,同时应采取的措施是:先通氢气点燃,再通氯气。
(三)(1)硫氰(SCN)2为共价化合物,按照共价键的书写规则,可得其结构式为N≡C-S-S-C≡N;
(2)(CN)2的性质与卤素单质相似,所以可以类比Cl2与KOH溶液的反应,由此可得(CN)2和KOH溶液反应的化学方程式为(CN)2 + 2KOH = KCN + KCNO+H2O
(3)阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。则氧化性Cl2>Br2>(CN)2>(SCN)2>I2,所以在NaBr和KSCN的混合溶液中加入(CN)2,(CN)2只能氧化SCN-为(SCN)2,而不能氧化Br-,所以反应的离子方程式为(CN)2+ 2SCN-= 2CN-+(SCN)2。


科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是_______;N2和H2的转化率比是_________。
(2)升高平衡体系的温度(保持体积不变),混和气体的平均相对分子质量__________,密度___________。(填“变大”、“变小”或“不变” )
(3)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减小一倍,平衡将向__________移动。
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将向_______________移动。
(5)若容器恒容,绝热、加热使容器内温度迅速升至原来的2倍,平衡将______________(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_____________(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是()
A. 偏二甲肼(C2H8N2)的摩尔质量为60g
B. 6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C. 1mol偏二甲肼(C2H8N2)的质量为60g/mol
D. 6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
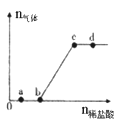
A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B.b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890kJ·mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B. 1∶3 C. 1∶4 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。
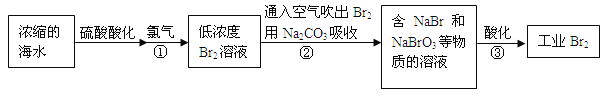
(1)NaBr的电子式是 。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是 。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是 。
(4)反应②的化学方程式是 。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是 mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBrb.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。请回答下列问题

(1)图1实验可通过什么现象来比较反应速率的快慢
(2)若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好。你认为该结论是否合理,请说明你的理由
(3)若想用图2装置测定反应速率,可需测定哪两个实验数据
(4)如何检查图2装置的气密性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
A. 平衡正移 B. (a+b)>(c+d)
C. Z的体积分数变小 D. X的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池的工作原理如右图所示,该电池反应为:
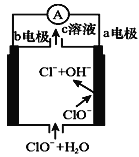
Mg+ClO-+H2O=Mg(OH)2+Cl-
下列有关说法正确的是( )
A.电池工作时,c溶液中的溶质是MgCl2
B.负极反应式:ClO--2e-+H2O=Cl-+2OH-
C.电池工作时,OH-向b电极移动
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com