
【题目】空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。
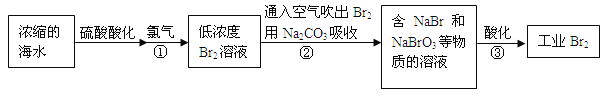
(1)NaBr的电子式是 。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是 。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是 。
(4)反应②的化学方程式是 。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是 mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBrb.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液
【答案】
(1)![]()
(2)Cl2+2Br—=Br2+2Cl—
(3)富集溴
(4)3Br2+3Na2CO3=5NaBr+3CO2+NaBrO3
(5)5(6)b
【解析】
试题分析:由流程可知,浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2Cl-,用空气将溴吹出,用纯碱溶液吸收,从而达到富集溴,②中发生3Br2+3Na2CO3═5NaBr+3CO2+NaBrO3,③中发生5Br-+6H++BrO3-═3Br2+3H2O。
(1)NaBr为离子化合物,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)反应①是氯气将Br-转化为Br2,反应①的离子方程式是Cl2+2Br-Br2+2Cl-,故答案为:Cl2+2Br-Br2+2Cl-;
(3)由上述分析可知,用Na2CO3吸收的目的是富集溴,故答案为:富集溴;
(4)由上述分析可知,反应②的化学方程式为3Br2+3Na2CO3═5NaBr+3CO2+NaBrO3,故答案为:3Br2+3Na2CO3═5NaBr+3CO2+NaBrO3;
(5)③中发生5Br-+6H++BrO3-═3Br2+3H2O,由NaBrO3中溴元素的化合价降低为5-0=5可知,每生成3mol Br2,转移电子的物质的量是5mol,故答案为:5;
(6)除去工业Br2中微量的Cl2,不能选碳酸钠、亚硫酸钠,均与溴、氯气反应,a会引入杂质,只有b中NaBr溶液与Cl2反应,然后分液可除去Cl2,故答案为:b。


科目:高中化学 来源: 题型:
【题目】一定温度下,有可逆反应:2A(g)+2B(g) ![]() C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
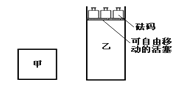
关于两容器中反应的说法正确的是( )
A.两容器达平衡后升高相同的温度时,甲容器的反应速率大于乙容器的速率
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的密度不同
C.甲容器中的反应先达到化学平衡状态
D.在甲容器中再充入2mol A和2 mol B,平衡后甲中物质C的物质的量是乙中物质C的物质的量的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,可逆反应2NO2![]() 2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2②混合气体的压强不再改变③混合气体的平均相对分子质量不再改变④单位时间内生成n mol O2,同时生成2n mol NO⑤混合气体的颜色不再改变⑥用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1.
A. ①④⑤⑥ B. ①②③⑤ C. ②③④⑥ D. 以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法正确的是( )

A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B.此装置用于铁表面镀铜时,a为铁b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,请配平化学方程式:10Al+6NaNO3 + 4NaOH + 18H2O === 10 ________ + 3N2↑。若反应过程中转移5mol电子,则生成标况下的N2体积为________ L。
(二)化工生产盐酸的主要过程如图1所示:

其中关键的一步为图2所示的氯气和氢气在燃烧管口燃烧,生成HCl。氯气有毒,为防止污染大气,为此通入气体的合理方式是:A处通入_______,B处通入______;同时应采取的措施是___ __。
(三)已知氰(CN)2、硫氰(SCN)2和(OCN)2、ICl、BrCl的性质与卤素单质相似,故称它们为拟卤素。回答下列问题。
(1)写出硫氰(SCN)2的结构式 。
(2)(CN)2和KOH溶液反应的化学方程式为:______________。
(3)已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]利用元素周期表中同族元素的相似性,可预测元素的性质。
(1)写出P元素的基态原子的核外电子排布式:__________,P元素的基态原子有_________个未成对电子。
(2)白磷的分子式为P4,其结构如下图所示。
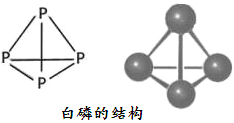
科学家目前合成了 N4分子,在N4分子中N原子的杂化轨道类型是___________,N—N键的键角为_____________
(3)N、P、As原子的第一电离能由大到小的顺序为_____________。
(4)立方氮化硼晶体的结构如下图所示:
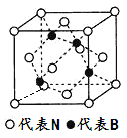
立方氮化硼晶体中,每个晶胞中B原子的个数为_____________。
(5)N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是____________;立方砷化镓晶体的晶胞边长为a pm(1pm=1×10-12m),则其密度为____________g·cm-3(用含a的式子表示,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用铜作电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.Fe3O4与过量的稀HNO3反应: Fe3O4+8H+ Fe2++2Fe3++4H2O
C.向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至Ba2+刚好沉淀完全:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.NaHS溶液呈碱性:HS-+H2O![]() H3O++OH-+S2-
H3O++OH-+S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应的离子方程式是: Zn+Cu2+===Zn2++Cu,依据此反应设计原电池的正确组合是
选项 | 正极 | 负极 | 电解质溶液 |
A | Cu | Zn | 稀盐酸 |
B | C | Zn | 硫酸铜溶液 |
C | Zn | Cu | 氯化铜溶液 |
D | Zn | Cu | 硝酸铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com