
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ������Ӻ���ֲ������ȡ����������£�
![]()
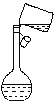
ij��ѧ��ȤС�齫���������ڢ���Ƴ���ͼ��ʾ��


��֪��ˮ�к���Cl2�����з�����Ӧ�Ļ�ѧ����ʽΪCl2��2KI=2KCl��I2��
�ش��������⣺
(1)д����ȡ�����٢���ʵ����������ƣ���________________����________________��
(2)F�������________________________��
(3)�ӵ�����Ȼ�̼��Һ�еõ����ʵ����еIJ�����________��ʵ��װ������ͼ��ʾ����ʵ����õļ��ȷ�ʽΪ_____________������A������Ϊ__________________��

(4)�����չ����У���ʹ�õ���(����������)ʵ��������____________��
A�Թ� B������ C����ǯ D������ E�ƾ���
(5)����CCl4�ӵ�ˮ����ȡ�Ⲣ�÷�Һ©������������Һ����ʵ������ɷֽ�Ϊ���¼�����
A����ʢ����Һ�ķ�Һ©����������̨����Ȧ�У�
B����50mL��ˮ��15mL CCl4�����Һ©���У����Ǻò�������
C�������Һ©���������ϿڵIJ������Ƿ�©Һ��
D����ת©������������ʱ�����������������رջ������ѷ�Һ©��������
E���������������ձ�������Һ��
F���ӷ�Һ©���Ͽڵ����ϲ�ˮ��Һ��
G����©���ϿڵIJ�������ʹ���ϵİ��ۻ�С��©�����ϵ�С�ף�
H�����ã��ֲ㡣
���������գ�
����ȷ���������˳���ǣ�(�������������ı����ĸ��д)
�� �� ��A��_________��G��E��F
������G���������Ŀ���� ��
���𰸡�
(1)������������ȡ
(2)��Һ�ֲ㣬�ϲ㼸��Ϊ��ɫ���²�Ϊ�Ϻ�ɫ��
(3)������ˮԡ������������ƿ
(4)BCE��
(5)��C��B��D��H �� ��ƽ��ѹ������Һ��������
��������
���������(1)�������̿�֪�����벻��������Һ�ķ���Ϊ���ˣ���Ϊ�����л��ܼ��е��ܽ�ȱ�ˮ���ҵ���л��ܼ����ڷ��룬��������ȡ���ʴ�Ϊ�����ˣ���ȡ��
(2)���Ȼ�̼������ˮ����ˮ�أ��ⵥ�������Ȼ�̼���ܽ�ȴ���ˮ�У����Ȼ�̼��Ϊ�Ϻ�ɫ���ϲ�Ϊ��Ҫ�������Ȼ������ʿ���������Ϊ��Һ�ֲ㣬�ϲ㼸��Ϊ��ɫ���²�Ϊ�Ϻ�ɫ���ʴ�Ϊ����Һ�ֲ㣬�ϲ㼸��Ϊ��ɫ���²�Ϊ�Ϻ�ɫ��
(3)�ӵ�����Ȼ�̼��Һ�еõ����ʵ�����ͨ������ķ�������������ʵ��װ��ͼ��ʾ����ʵ�������ˮԡ���ȷ�ʽΪ������AΪ������ƿ���ʴ�Ϊ������ˮԡ���ȣ�������ƿ��
(4)�����չ����У���ʹ�õ�ʵ�������������ǡ�������������ǯ���ƾ��ƣ���ѡBCE��
(5)��CCl4�ӵ�ˮ����ȡ�Ⲣ�÷�Һ©������������Һ������Ϊ��©��װҺ��������������Һ������ΪC��B��D��A��G��H��E��F���ʴ�Ϊ��C��B��D��H��
��(G)����Ŀ��ƽ��ѹ����Ϊ����ʱ©����Һ���ܹ��������ʴ�Ϊ��ƽ��ѹ������Һ��������


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д� һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ���������к����ĸߵͿɷ�Ϊ����Ԫ�غ���Ԫ�ء�����Ԫ���У�����Ϊ����Ԫ�ص���( )
A��H B��N C��O D��Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪һ�����淴Ӧ��������ӦΪ�Է����̣������淴ӦΪ���Է����̣���֮��Ȼ��
(1)��֪2CO(g)![]() CO2(g)��C(s)��T��980 Kʱ��H��T��S��0������ϵ�¶ȵ���980 Kʱ�����Ʀ�H��T��S________0(����ڡ�����С�ڡ����ڡ�����ͬ)������ϵ�¶ȸ���980 Kʱ�����Ʀ�H��T��S________0��
CO2(g)��C(s)��T��980 Kʱ��H��T��S��0������ϵ�¶ȵ���980 Kʱ�����Ʀ�H��T��S________0(����ڡ�����С�ڡ����ڡ�����ͬ)������ϵ�¶ȸ���980 Kʱ�����Ʀ�H��T��S________0��
(2)���ӹ�ҵ����ϴ��Ƭ�ϵ�SiO2(s)�ķ�ӦΪSiO2(s)��4HF(g)===SiF4(g)��2H2O(g) ��H(298.15 K)����94.0 kJ/mol����S(298.15 K)����75.8 J/(mol��K)���覤H�ͦ�S�����¶ȶ��仯����˷�Ӧ�Է����е��¶���________��
(3)��ѧ��Ӧ2NO(g)��2CO(g)===N2(g)��2CO2(g)��298 K��100 kPa�£���H����113.0 kJ/mol����S����145.3 J/(mol��K)����Ӧ�ڳ�����________(��ܡ����ܡ�)�Է����С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ������Ҫ450 mL 1.0 mol��L��1��������Һ��ijС���ͬѧ�������ʵ�鲽�貢���˽������ƣ���ش�������⡣(��֪����98%Ũ������ܶ�Ϊ1.84 g/mL)
��������98%��Ũ����������
�����ձ��н�Ũ����ϡ�ͣ�
�����Ž�ϡ�ͺ������ת�Ƶ�����ƿ�У�
��ϴ���ձ��Ͳ�����3�Σ�����ϴ��Һת�Ƶ�����ƿ�У�
�����ݣ�
��ҡ�ȡ�
(1)��ʵ����ѡ�õĶ�������������Ͳ�⣬����________________��
(2)��ʵ��Ӧ����(�����)_____ ______����Ͳ(�ɹ�ѡ�����Ͳ���Ϊ10 mL��15 mL��20 mL��50 mL��100 mL)����ȡ___________mL 98%��Ũ���ᡣ
(3)�������ƹ����У����û��ϴ���ձ��Ͳ�������������������ȷ����ô������Һ��ʵ��Ũ�Ƚ�_____________(����ƫ��ƫС����Ӱ����)
��ijͬѧת����Һ�IJ�����ͼ��ʾ����ͬѧ�����еĴ����� ��
�����ý�ͷ�ιܶ���ʱ����С�ĵ�ˮ�ι��˿̶��ߣ�����ΪӦ�ò�ȡ�Ĵ��������ǣ� ��
�����в����У����������������Һ��Ũ��ƫ�ߵ��� (��ѡ��)��
a���ܽ��û����ȴ�����¾ͽ�Һ��ת��������ƿ��
b������ʱ�����ӿ̶���
c��ϴ�Ӻ������ƿ�в�����������ˮ
d������Ͳ��ȡŨ���ᣬ����ʱ���ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ﰺ�Ŀ�ѧ�ҷ���һ��ֻ���ĸ�������ɵ�������������Ϊ������������Ҳ���˳�֮Ϊ�������Ԫ�ء����������е������ǹ������ơ��йظ���˵����ȷ����
A. �������Ե��� B. ������������Ϊ2
C. ��Ԫ�����ڱ�������Ԫ��ռͬһλ�� D. ������ͨ���ӻ���ͬλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ɺ���������������ĺ���,��11 km,��ѧ�ҽ��п���ʱ���ֺ��������Ϻ,ȴû����ɫֲ����ԭ����( )��
A��û������ B���¶�̫�� C��ѹǿ̫�� D��ȱ��CO2��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������в���ȱ�ٵ�Ԫ��֮һ������Ȼ�����������������ε���ʽ���ֵģ���������ƿ�Ca3��PO4��2����ʯCa5F��PO4��3�ȣ�
��1����ij�ֺ����У�����������������1�����ʾ�ú��ص�ԭ�ӷ���Ϊ ��
��2��������P4������Ca3��PO4��2����̿��SiO2�ڵ�¯����Լ1550������ͨ������������Ӧ���۵õ���
��2Ca3��PO4��2��s��+5C��s���T6CaO��s��+P4��s��+5CO2��g����H1=+Q1kJmol��1
��CaO��s��+SiO2��s���TCaSiO3��s����H2=��Q2kJmol��1
д����¯�з����ܷ�Ӧ���Ȼ�ѧ����ʽ ��
��3��������뽹̿��ʯӢɰ��ϣ��ڵ�¯�м��ȵ�1500�����ɰ��ף���ӦΪ��2Ca3��PO4��2+6SiO2=6CaSiO3+P4O10��10C+P4O10=P4��+10CO����������Ӧ�еĸ������ʣ������������������ ��
���������ӽ���Ĥ��һ��������ӽ������ܵĸ߷��Ӳ��ϣ�һ���������ӽ���Ĥ�ֳ����������֣�����ͼ��ʾ�����ý���ĤΪ�����ӽ���Ĥ��ֻ��������������ͨ��������߳��������ữ��H2O2��Һ���ұ߳�������KSCN��Һ��FeCl2��Һ����������һ��ʱ����ұ߿ɹ۲쵽������ �����ý���ĤΪ�����ӽ���Ĥ��ֻ��������������ͨ��������߳�����2mol NH4Al��SO4��2����Һ���ұ߳�����3mol Ba��OH��2����Һ������2mol SO42��ͨ������Ĥʱ������ӦѸ����ȫ�������������ҳ��������ʵ���֮��Ϊ ��
![]()
������ij����ʯī�к�SiO2��7.8%����Al2O3��5.1%����Fe2O3��3.1%����MgO��0.5%�������ʣ�������ع��տɽ����ᴿ���ۺ����ã�ͨ��һ������N2����1500������Cl2��ַ�Ӧ�õ�����ʯī���������Ȼ������80�����ֱ�õ���ͬ״̬����������a��b����ע��ʯī�����������ʾ�ת��Ϊ��Ӧ���Ȼ��SiCl4�ķе�Ϊ57.6���������Ȼ���ķе������150������
��1����a�������NaOH��Һ��Ӧ���ɵ������Σ�����һ���ε�ˮ��Һ����ճ���ԣ���ѧ��Ӧ����ʽΪ ��
��2����b�������NaOH��Һ��ַ�Ӧ���ˣ�������Һ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����٤�������ɱ�ʾΪNA��������˵����ȷ����( )
A��17gNH3����������ĿΪ10 NA
B�����³�ѹ�£�22 g������26 g������������ԭ������Ϊ3NA
C�����³�ѹ�£�18g H2O���еĵ�������Ϊ8NA
D�����³�ѹ�£�2.24LCO��CO2��������к��е�̼ԭ����ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧԪ��������������������Ԫ�ص��ǣ� ��
A. K B. P C. B D. Ca
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com