
下列反应的离子方程式书写正确的是
A.氯气与氢氧化钠溶液反应:Cl2 + 2OH-=Cl-+ ClO-+ H2O
B.碳酸钙与稀醋酸反应:CO32-+ 2CH3COOH =2CH3COO-+ H2O + CO2↑
C.铁粉与稀盐酸反应:2Fe + 6H+=2Fe3+ + 3H2↑
D.铜片与氯化铁溶液反应 Cu + Fe3+ =Cu2+ + Fe2+
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.生石灰作干燥剂
C.氢氟酸刻蚀玻璃 D.液氨用作制冷剂
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第三次模拟化学试卷(解析版) 题型:选择题
下列图示与对应叙述相符合的是
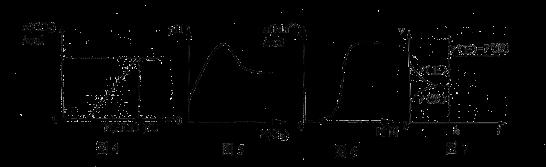
A.图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
B.图5表示Cl2通入H2S溶液中pH的变化
C.图6表示10 mL 0.01 mol·L-1KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4
溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用)
D.图7表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省泰州市姜堰区高二上学期期中选修化学试卷(解析版) 题型:填空题
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)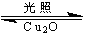 2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
上述反应过程中能量转化形式为光能转化为 能,达平衡过程中至少需要吸收光能为 kJ。
(2)现有反应:CO(g)+ H2O(g) 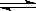 CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
物质的量 | CO | H2 O | CO2 | H2 |
甲 | a mol | a mol | 0 mol | 0 mol |
乙 | 0mol | 0 mol | 2a mol | a mol |
丙 | 0 mol | 0 mol | a mol | a mol |
丁 | a mol | a mol | a mol | a mol |
上述四种情况达到平衡后,甲、乙、丙、丁容器中n(CO)的大小顺序为 。
(3)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3得金属钨,总反应为WO3 (s) + 3H2 (g) W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:
①某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为 。
②上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
主要成份 | WO3 W2O5 WO2 W |
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
③钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) 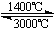 WI4 (g)。下列说法正确的有 (填字母)。
WI4 (g)。下列说法正确的有 (填字母)。
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上第一次月考化学试卷(解析版) 题型:填空题
(10分)科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)。
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2 (填“能”或“不能”)和草木灰混合施用。
(3)已知断裂1molN—N吸收167kJ热量,生成1molN N放出942kJ。写出N4气体转变为N2的热化学方程式: 。
(4)已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为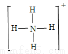 ,白磷(P4)的结构式为
,白磷(P4)的结构式为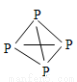 ,请画出N4H44+的结构式 。
,请画出N4H44+的结构式 。
(5)已知液氨中存在着平衡2NH3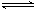 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子和另一种单质气体,请写出液氨与氢氧化铯反应的化学方程式: 。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子和另一种单质气体,请写出液氨与氢氧化铯反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,2.3g变成Na2O2时,失去0.2NA个电子
B.常温常压下,32 g氧气和32 g臭氧都含有2NA个氧原子
C.500 mL 0.2 mol/L NaOH溶液中含有NA个Na+离子
D.2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古赤峰市宁城县高三上学期第一次统考化学试卷(解析版) 题型:填空题
铁及其化合物在日常生活、生产中应用广泛。研究铁及其化合物的应用意义重大。
I.水体的净化和污水的处理与铁及其化合物密切相关。
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理_______________。
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
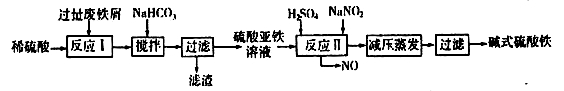
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
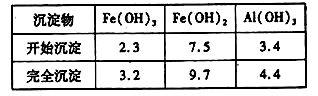
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式___________。
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为____________。
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为____________g。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为___________。
II铁的化合物也是制备高能锂电池的重要原料。已知磷酸亚铁锂电池总反应为:
FePO4+Li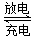 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏丹阳中学高二上10月月考化学试卷(解析版) 题型:选择题
只用一种试剂就能将甲苯、己烯、四氯化碳、碘化钾溶液区别,该试剂可以是
A.高锰酸钾酸性溶液 B.溴水
C.溴化钾溶液 D.硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com