

| A.工业上以黏土、石灰石和石英为主要原料来制造普通水泥 |
| B.负极的电极反应式为 2Cu + 2OH- —2e- = Cu2O + H2O |
| C.测量原理示意图中,电流方向从 Cu 经过导线流向 Ag2O |
| D.电池工作时,溶液中 OH-向正极移动 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
 2PbSO4+2H2O
2PbSO4+2H2O 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2、64、24 | B.64、2、24 | C.32、50、12 | D.16、50、24 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
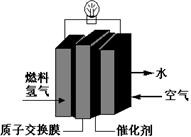
| A.通入空气的电极发生氧化反应 |
| B.通入氢气的电极为正极 |
| C.正极的电极反应式为:O2+4H+-4e-==2H2O |
| D.总反应式为:O2+2H2==2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
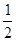 H2+NiO(OH)
H2+NiO(OH) Ni(OH)2,根据此反应式判断,下列叙述中正确的是
Ni(OH)2,根据此反应式判断,下列叙述中正确的是| A.电池放电时,电池负极周围溶液pH不断增大 | B.电池放电时,镍元素被氧化 |
| C.电池充电时,氢元素被氧化 | D.电池放电时,H2是负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O2在正极发生还原反应 | B.电池总反应为2H2 + O2 = 2H2O |
| C.反应时负极附近c(OH-)增大 | D.氢氧燃料电池属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe(OH)2+ Ni(OH)2,下列有关该电池的叙述中正确的是
Fe(OH)2+ Ni(OH)2,下列有关该电池的叙述中正确的是 | A.放电时Fe作负极,放电时溶液中的阳离子向正极移动 |
| B.充电时阳极的电极反应式为:Fe(OH)2 +2e-="=" Fe + 2OH- |
| C.充电时电池上标注“+”的电极应与外接电源的负极相连 |
| D.该蓄电池可能用稀H2SO4作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| A.CuSO4溶液 | B.CuCO3固体 | C.CuO固体 | D.Cu(OH)2固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若根据反应“H2+Cl2=2HCl”设计成燃料电池,既可发电同时还可用于工业制盐酸 |
| B.冰醋酸中逐滴加水,则溶液的导电性和醋酸的电离程度均先增大后减小 |
| C.某反应△H>0,△S>0,该反应可能自发进行 |
D.25℃时,NaClO溶液的pH=8,c(Na-)—c(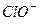 )=9.9×10-7mol/L. )=9.9×10-7mol/L. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com