
����Ŀ����ش�����������
��1�������������ļ��������������з��������ٵ���________________����״���������С����_____________________��
��1gH2 ��2.408��1023��CH4���� ��10.8gH2O ����״����6.72LCO2
��2������ƽ����ʽ��___KClO3+____HCl��Ũ��=___KC1+____ ClO2��+___Cl2��+__H2O��__________
��3����Һ��������ȡ���������ƶ����ӵ�Ũ�Ⱥ����������������Ũ��Խ�����������Խ�࣬��Һ��������Խǿ������Ũ�Ⱦ�Ϊlmol/L�����µ������Һ����K2CO3 ��AgNO3 ��NaHSO4 ��Al2(SO4)3��H2SO4 ��Ba(OH)2����Щ��Һ�е���������ǿ����__________���������������������������____________��
��4����12.4gNa2R��Na+Ϊ0.4mol����Na2R��Ħ������Ϊ____________��
��5����0.2L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ���û����Һ��CuCl2�����ʵ���Ũ��Ϊ____________ molL-1��

��6����ͼ��ʾ�ľ�ʾ��־����һ��____________����ѡ���������

A.��ȼƷ B.�綾Ʒ C.��ʴƷ D.��ըƷ
���𰸡� �� �� 2 KClO3+ 4 HCl��Ũ��= 2 KCl+ 2 ClO2��+ 1 Cl2��+ 2 H2O �� �� 62g/mol 0.5mol��L-1 C
����������1����n��H2��=![]() =0.5mol��V��H2��=0.5mol��22.4L/mol=11.2L����n��CH4��=
=0.5mol��V��H2��=0.5mol��22.4L/mol=11.2L����n��CH4��=![]() =0.4mol��V��CH4��=0.4mol��22.4L/mol=8.96L����n��H2O��=
=0.4mol��V��CH4��=0.4mol��22.4L/mol=8.96L����n��H2O��=![]() =0.6mol�����ԼΪ10.8mL����n��CO2��=
=0.6mol�����ԼΪ10.8mL����n��CO2��=![]() =0.3mol����״�������Ϊ6.72L�����ʵ���Խ�٣�������Խ�٣����ٵ��Ǣܣ���״���������С���Ǣۣ�(2) ������е�+5����ȫ��ת��Ϊ���������е�+4���ȣ� HCl��Cl��-1�۱�Ϊ0�ۣ����ݻ��ϼ����������غ㡢�����غ���ã�2KClO3+4HCl��Ũ��=2 KCl+2ClO2��+1Cl2��+ 2 H2O����3����Һ�������ƶ������ӹ�Ũ��Խ�����������Խ�࣬��ʱ��Խǿ����֮Խ���������Щ��Һ�е���������ǿ��������������ѡ�ܣ�����������������AgNO3����ѡ�ڣ���4����Һ�еĵ���غ㣺c��Na+����1+c��Mg2+����2+c��Cu2+����2=c��Cl������1��1.0 molL��1 +0.5 molL��1��2+c��Cu2+����2=3 molL��1��1��c��Cu2+��=0.5 molL��1��c��CuCl2��=0.5 molL��1����6����ʾ��־
=0.3mol����״�������Ϊ6.72L�����ʵ���Խ�٣�������Խ�٣����ٵ��Ǣܣ���״���������С���Ǣۣ�(2) ������е�+5����ȫ��ת��Ϊ���������е�+4���ȣ� HCl��Cl��-1�۱�Ϊ0�ۣ����ݻ��ϼ����������غ㡢�����غ���ã�2KClO3+4HCl��Ũ��=2 KCl+2ClO2��+1Cl2��+ 2 H2O����3����Һ�������ƶ������ӹ�Ũ��Խ�����������Խ�࣬��ʱ��Խǿ����֮Խ���������Щ��Һ�е���������ǿ��������������ѡ�ܣ�����������������AgNO3����ѡ�ڣ���4����Һ�еĵ���غ㣺c��Na+����1+c��Mg2+����2+c��Cu2+����2=c��Cl������1��1.0 molL��1 +0.5 molL��1��2+c��Cu2+����2=3 molL��1��1��c��Cu2+��=0.5 molL��1��c��CuCl2��=0.5 molL��1����6����ʾ��־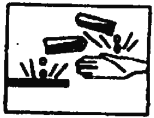 �Ǹ�ʴƷ����ѡC��
�Ǹ�ʴƷ����ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�����ͼ��ʾ��ʵ��װ�������Բⶨ��ʯ��̼���Ƶ�����������
��1����ƿ�з�����Ӧ�Ļ�ѧ����ʽ�� �� װ��B��C�������� �� ��ƿҪ������˵�ʯ��Ӧ������Ƥ��������Ϊ��
��2�����õ�ʯ��������̫������Ҳ����̫С������ �� ������B���ݻ�Ϊ250mL�������õĵ�ʯ����Ӧ��g���ң�������������ѡ�0.30��0.60��1.00��1.50��2.00��
��3��Ϊ�˵õ��Ƚ�ƽ�ȵ���Ȳ����������������ˮ��
��4��ʵ���в��������Ͳ��ˮ�����ΪV mL��1.01��105 Pa��0�棩����ʯ����ΪW g�����ʯ��̼���Ƶ����������� �� �����Ƶ����в�����ˮ�������б���ˮ�����ɺ��Բ��ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(SOCl2)��һ����ɫ�ӷ�Һ�壬��ˮ����ˮ�������������壬��������ˮ�������۵�Ϊ-105�棬�е�Ϊ79�棬140������ʱ�ֽ⡣
��1��д��SOCl2����ˮ�����Ļ�ѧ����ʽ:_________________
��2����ͬѧ�����ͼ��ʾװ��,��ZnCl2��xH2O������ȡ��ˮZnCl2������SOCl2����֤�������к���SO2(�гּ�����װ����)��

��װ�õ�����˳��ΪA��B��______��_____��_____��(����ĸ)
�������ܵ�������____________��
��ʵ�������Ϊ���ZnCl2��xH2O�����Ƿ���ȫ��ˮ����ȡ���ɺ�Ĺ���ag����ˮ����������ϡ�������������Һ�����ˡ����С�����Ƶù���Ϊbg����![]() =___ (��ȷ��0.1)������֤��ZnCl2��xH2O��������ȫ��ˮ��
=___ (��ȷ��0.1)������֤��ZnCl2��xH2O��������ȫ��ˮ��
��3����ͬѧ��ΪSOCl2����������FeCl3��6H2O��ȡ��ˮFeCl3����ˮ��������ͬѧ��Ϊ��ʵ���лᷢ��������ԭ��Ӧ��������Ʋ�����ʵ�鷽���жϱ�ͬѧ�Ĺ۵�:____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƽ�����̣�����������ȵ�A��B���ձ�������ƽ�⣬Ȼ��ֱ���������ȵ��������ᣬ�̶���AB���ձ��з��������������ʣ������ƽ�Ա���ƽ����ǣ���
A. 0.8molNa��0.5molMg B. 0.1molZn��0.1molAl
C. 8.4gMgCO3��8.4gNaHCO3 D. 10gCaCO3��10gMgCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Һ��ͨ����������������ͬʱ�õ������ԭ����ͼ��ʾ(ͼ��HA��ʾ������ӣ�A-��ʾ���������)������˵����ȷ����

A. ͨ�����������PH���� B. ���ӴӸ������������Һ�ص�����
C. ͨ���A-ͨ�������ӽ���Ĥ����������Ũ���� D. ����·��ͨ��2mol���ӵĵ���ʱ������11.2LO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г������ʵ�ת����ϵ���������ʺͷ�Ӧ������ȥ��
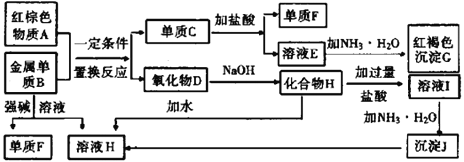
��1������Ѻ���ɫ����A���ɺ�ɫ���Ծ��壬�Ʋ��������������ȫһ�µģ���д����ɫ���Ծ�����������ᷴӦ�Ļ�ѧ����ʽ_______________________________��
��2��д������B��ǿ����Һ��Ӧ�����ӷ���ʽ��_______________________________������Һ���е���������ȫת��Ϊ����JΪʲô�Ӱ�ˮ��������������_______________��
��3����ҺE�м��백ˮʱ�������ɰ�ɫ����L��д������L�����ӷ���ʽ��_________________________����ɫ����L���ձ�Ϊ���ɫ����G��д��L��ΪG�Ļ�ѧ��Ӧ����ʽ_________________________��
��4������E��Һʱ��ΪʲôҪ���뵥��C�������ӷ���ʽ����_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش�����
��1��KAl(SO4)2�ĵ��뷽��ʽ_______________________��
��2����ʯ����Һ��ͨ����������ʼʱ��Һ��죬һ��ʱ�����Һ��ɫ����ʹ��Һ������ɫ�����ֱ���______________��_________________ (��������)��
��3��ʵ��������������Ϊ36.5%���ܶ�Ϊ1.19g��cm-3��Ũ����������100ml��2mol/L��ϡ���ᣬ��Ҫ����Ͳ��ȡ_______________ml��Ũ���ᡣ
��4����ѧ����ʽH2S+H2SO4(Ũ)=SO2��+S��+2H2O��������4.48L(���) SO2ʱ��ת�Ƶĵ�����__________mol��
��5�������ĸ�ͼ���У��������ʾ�������ʵ����ʵ������������ʾ���ɳ�����������������������A��D��ѡ����ϸ���Ҫ���������˱��С�
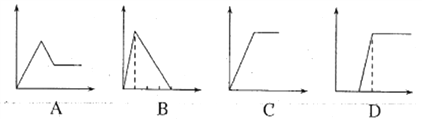
��Һ | ��������� | ��� |
��AlCl3��Һ | ͨ�������NH3 | ___ |
��Na2CO3��NaOH����Һ | ������������� | ___ |
��NaAlO2��Һ | �μ�ϡ���������� | ___ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3��ˮ��Һ����ˮ������Fe ��OH��3�����ᣬ�йط�Ӧ��ѧ����ʽ�����������ɲ��������յõ� �� ���ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧѧϰС��Ϊ��ȡ��������֤�����Ļ�ѧ���ʣ����������ʵ��װ�ã��밴Ҫ��ش����⡣��֪���Լ�ƿװ���Լ�Ϊ��B��H2S��ˮ��Һ����C��KI������Һ����D��FeBr2��Һ����E������SO2��BaCl2��Һ����F��ˮ����H����ɫʯ����Һ��

��1��A����������װ�ã��仯ѧ��Ӧ����ʽ��________________________________��
��2������bƿ�ڼ����Һ�������________��
��3��B�в�������ɫ�ĵ������������д����Ӧ�Ļ�ѧ����ʽ��______________________
��4��C�е�ʵ������Ϊ______________________
��5��D�е�ʵ������Ϊ______________________
��6��E�в�����ɫ��������������������Ӧ����д��������������ԭ��Ӧ�����ӷ���ʽ��____________________________________
��7��Gװ�õ�Ӳ�ʲ�������ʢ��̿�ۣ�����������ԭ��Ӧ�������Ϊ������̼���Ȼ�������д��G�з�����Ӧ�Ļ�ѧ����ʽ��_____________________________________��
��8��H�е�ʵ������Ϊ____________________________________________����ԭ����___________________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com