
【题目】某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.
(1)烧瓶中发生反应的化学方程式是 . 装置B和C的作用是 . 烧瓶要干燥,放人电石后应塞紧橡皮塞,这是为了
(2)所用电石质量不能太大,否则;也不能太小,否则 . 若容器B的容积为250mL,则所用的电石质量应在g左右.(从以下数据选填:0.30、0.60、1.00、1.50、2.00)
(3)为了得到比较平稳的乙炔气流,常可用代替水.
(4)实验中测得排入量筒中水的体积为V mL(1.01×105 Pa,0℃),电石质量为W g.则电石中碳化钙的质量分数是 . (不计导管中残留的水,气体中饱和水蒸气可忽略不计)
【答案】
(1)CaC2+2H2O→Ca(OH)2+C2H2↑;贮水以使烧瓶中产生的气体CH≡CH进入B时排出与它等体积的水,进入量筒C测定乙炔的体积;防止电石与残留的水作用,防止产生的乙炔逸散到大气中
(2)生成C2H2太多,超过B的空间;生成的C2H2太少,测定误差会更大;0.60
(3)饱和食盐水
(4)![]() %
%
【解析】解:(1)电石和水反应的方程式为CaC2+2H2O→Ca(OH)2+C2H2↑;装置B用于贮水以便烧瓶中生成的C2H2气体进入B时排出与它等体积的水进入量筒C来测定生成乙炔的量;电石和水反应生成乙炔,烧瓶要干燥,放入电石后应塞紧橡皮塞,否则产生的乙炔逸散到大气中产生误差,所以答案是:CaC2+2H2O→Ca(OH)2+C2H2↑;贮水以使烧瓶中产生的气体CH≡CH进入B时排出与它等体积的水,进入量筒C测定乙炔的体积;防止电石与残留的水作用,防止产生的乙炔逸散到大气中;(2)若电石的质量太大,则生成C2H2太多,超过B的空间,无法测定其体积;若选择的电石的质量太小,则生成的C2H2太少,测定误差会更大.根据1molCaC2﹣1molC2H2 , 可计算产生250mLC2H2时所需电石的质量为0.71g,即需要电石的最大质量不能超过0.71g,结合题目信息,应选择0.60g电石进行实验;所以答案是:生成C2H2太多,超过B的空间;生成的C2H2太少,测定误差会更大;0.60;(3)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;所以答案是:饱和食盐水;(4)设产生VmL气体需要CaC2的质量为mg,则
CaC2﹣﹣﹣﹣﹣C2H2 ,
64g 22400mL
m VmL
解得m=0.0029V,则电石中CaC2的质量分数= ![]() ×100%=
×100%= ![]() %;
%;
所以答案是: ![]() %.
%.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】过硫酸钾(![]() )具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解.实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解.实验室模拟工业合成过硫酸钾的流程如下:
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液.写出电解时发生反应的离子方程式________________________.
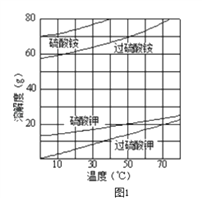
(2)已知相关物质的溶解度曲线如图1所示.在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,__________________________,干燥.
(3)样品中过硫酸钾的含量可用碘量法进行测定.实验步骤如下:
步骤1:称取过硫酸钾样品0.3000g于碘量瓶中,加入30mL水溶解.
步骤2:向溶液中加入4.000g KI固体(略过量),摇匀,在暗处放置30min.
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.1000molL﹣1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00mL.(已知反应:I2+2S2O32﹣=2I﹣+S4O62﹣)
①若步骤2中未将碘量瓶“在暗处放置30min”,立即进行步骤3,则测定的结果可能_______(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是_________.
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______.
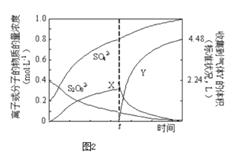
(4)将0.40mol过硫酸钾与0.20mol硫酸配制成1L溶液,在80℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图2所示(H+浓度未画出).图中物质X的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,有两瓶体积相等的CO和CO2,这两种气体中所含的分子数目之比为___,所含的原子总数目之比为___,质量比为___,密度之比为___。
(2)在Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O反应中,
CuSO4+ SO2↑+ 2H2O反应中,
①______元素被氧化,_______是氧化剂。
②用双线桥标出该反应电子转移的方向和数目。
Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O
CuSO4+ SO2↑+ 2H2O
③若有2.4mol的H2SO4参与反应,则被还原的H2SO4为___g,生成标况下的二氧化硫气体_______ L,转移电子的数目为_______________。(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)乙烯与溴化氢在一定条件下反应:反应类型:
(2)甲烷与氯气在光照的条件下生成一氯甲烷:反应类型:
(3)写出2﹣氯丙烷与氢氧化钠醇溶液反应的化学方程式:反应类型:
(4)写出2﹣氯丙烷与氢氧化钠水溶液反应的化学方程式:反应类型: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一气态烷烃和一气态单烯烃组成的混合气体,在同温同压下对氢气的相对密度为13,标准状况下将此混合气体29.12L通入足量溴水中,溴水的质量增加21.0g.
(1)混合气体中的气态烷烃是?
(2)混合气体中单烯烃的分子式是?其结构简式是?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的氢气体积(相同条件下)相等时,消耗的HCl和NaOH物质的量之比为( )
A. 1:1 B. 2:1 C. 3:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g)2Z(g),有关下列图象的说法正确的是( )
A.依据图a可判断正反应为吸热反应
B.在图b中,虚线可表示压强增大
C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)下列所给出的几组物质中:含有分子数最少的是________________;标准状况下体积最小的是_____________________。
①1gH2 ②2.408×1023个CH4分子 ③10.8gH2O ④标准状况下6.72LCO2
(2)请配平方程式:___KClO3+____HCl(浓)=___KC1+____ ClO2↑+___Cl2↑+__H2O,__________
(3)溶液导电能力取决于自由移动离子的浓度和所带电荷数,离子浓度越大,所带电荷数越多,溶液导电能力越强。现有浓度均为lmol/L的以下电解质溶液:①K2CO3 ②AgNO3 ③NaHSO4 ④Al2(SO4)3⑤H2SO4 ⑥Ba(OH)2。这些溶液中导电能力最强的是__________(填序号),导电能力最弱的是____________。
(4)有12.4gNa2R含Na+为0.4mol,则Na2R的摩尔质量为____________。
(5)在0.2L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。该混合溶液中CuCl2的物质的量浓度为____________ molL-1。

(6)下图所示的警示标志,是一种____________(填选项序号)。

A.易燃品 B.剧毒品 C.腐蚀品 D.爆炸品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com