
【题目】把下列四种X溶液分别加入四个盛有10 mL 2 mol/L盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10 ℃,20 mL 3 mol/L 的X溶液
B.20 ℃,30 mL 2 mol/L的X溶液
C.20 ℃,10 mL 4 mol/L的X溶液
D.10 ℃,10 mL 2 mol/L的X溶液
科目:高中化学 来源: 题型:
【题目】下图为C、H、0、N、P等元素构成化合物甲、乙、丁及结构丙的示意图,下列说法错误的是
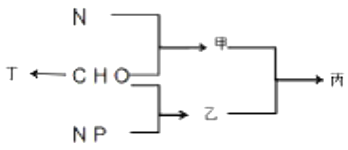
A. 若基因在结构丙上呈线性排列,则甲的单体用双缩脲试剂检测呈紫色
B. 若丁是真核细胞中良好的储能物质,则其合成场所为一种具膜的细胞器
C. 若丙是原核细胞内蛋白质合成场所,则乙彻底水解产物有6种
D. 若丙是一种生物膜,则其功能与膜上甲的种类和数量有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题。
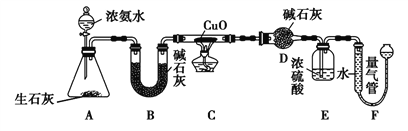
(1)写出A装置中发生反应的化学方程式__________。
(2)实验中观察到C装置中黑色CuO粉末变为红色固体,量气管中有无色无味的气体产生,上述现象证明NH3具有____性,写出相应的化学方程式______。
(3)读取气体体积前,对F装置进行的操作是慢慢上下移动右边的漏斗,使左右两管液面相平,其目的是________________。
(4)E装置的作用是___________;量气管中有空气,对实验______(填“有”或“无”)影响。
(5)实验完毕,若测得干燥管D增重mg,F装置测得气体的体积为VL(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、V的代数式表示)。若拆掉B装置,测得的结果____(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种短周期元素,已知相邻的A,B,C,D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.
回答下列问题: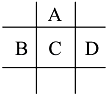
(1)A与E形成的化合物的化学式是 .
(2)B的最高价氧化物化学式为 , C的元素名称为 , D的单质与水反应的方程式为
.
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 , 有关反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NO2与水的反应:3NO2+H2O═2NO3﹣+NO+2H+
B.氯气通入水中:Cl2+H2O═2H++Cl﹣+ClO﹣
C.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
D.向硅酸钠溶液中通入SO2:SiO32﹣+2H+═H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合金的下列说法不正确的是
A.合金具备金属的特性
B.合金的硬度一般比其组成成分金属的硬度大
C.合金的熔点一般比其组成成分的熔点低
D.合金只能由两种或两种以上的金属组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2-硝基-1,3-苯二酚是橘黄色固体,易溶于水、溶液呈酸性,沸点为88℃,是重要的医药中间体。实验室常以间苯二酚为原料分以下三步合成:

具体实验步骤如下:
①磺化:称取5.5g碾成粉状的间苯二酚放入烧杯中,慢慢加入浓硫酸并不断搅拌,控制温度为60~65℃约15min。
②硝化:将烧杯置于冷水中冷却后加入混酸,控制温度(25±5) ℃左右继续搅拌15min。
③蒸馏:将反应混合物移入圆底烧瓶B中,小心加入适量的水稀释,再加入约0.1g尿素,然后用下图所示装置进行水蒸气蒸馏;将馏出液冷却后再加入乙醇-水混合剂重结晶。
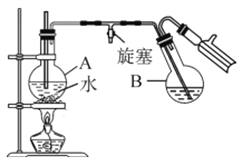
回答下列问题:
(1)实验中设计Ⅰ、Ⅲ两步的目的是__________。
(2)烧瓶A中玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能_______
(3)步骤②的温度应严格控制不超过30℃,原因是_____________。
(4)步骤③所得2-硝基-1,3-苯二酚中仍含少量杂质,可用少量乙醇-水混合剂洗涤。请设计简单的实验证明2-硝基-1,3-苯二酚已经洗涤干净:______________。
(5)本实验最终获得1.0g橘黄色固体,则2-硝基-1,3-苯二酚的产率约为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置,能完成很多电化学实验。下列有关此装置的叙述中,不正确的是
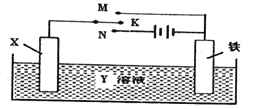
A. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大。A原子的最外层电子数是次外层电子数的2倍,C的氢化物在常温下为液体,D能形成DF型离子化合物,0.9 g E与足量的稀硫酸反应生成的氢气在标准状况下的体积为1.12 L,F的族序数与周期序数之差为4。请回答下列问题:
(1)写出元素符号:A________;B________; F_________。
(2)六种元素中,单质还原性最强的是______(写化学式,下同);最高价氧化物对应水化物中酸性最强的酸是__________。
(3)写出C与D形成的原子个数比为1:1的化合物的电子式:______所含化学键类型为______。
(4)六种元素中的三种元素组成的某种盐的水溶液呈碱性,是家用消毒剂的主要成分,请用离子方程式解释该盐溶液呈碱性的原因:_____________。
(5)D、E元素的最高价氧化物对应的水化物发生反应的离子方程式为_________。
(6)写出用惰性电极电解饱和DF溶液的化学方程式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com