
����Ŀ����֪��2-����-1��3-���������ٻ�ɫ���壬������ˮ����Һ�����ԣ��е�Ϊ88��������Ҫ��ҽҩ�м��塣ʵ���ҳ��Լ䱽����Ϊԭ�Ϸ����������ϳɣ�

����ʵ�鲽�����£�
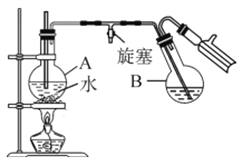
�ٻǻ�����ȡ5.5g��ɷ�״�ļ䱽���ӷ����ձ��У���������Ũ���Ტ���Ͻ��裬�����¶�Ϊ60~65��Լ15min��
�����������ձ�������ˮ����ȴ�������ᣬ�����¶�(25��5) �����Ҽ�������15min��
��������Ӧ���������Բ����ƿB�У�С�ļ���������ˮϡ�ͣ��ټ���Լ0.1g���أ�Ȼ������ͼ��ʾװ�ý���ˮ�����������Һ��ȴ���ټ����Ҵ�-ˮ��ϼ��ؽᾧ��
�ش��������⣺
��1��ʵ�������������������Ŀ����__________��
��2����ƿA�в���������ѹ���ã����ܷ�ֹװ����ѹǿ���������¹ʣ�����_______
��3������ڵ��¶�Ӧ�ϸ���Ʋ�����30����ԭ����_____________��
��4�����������2-����-1��3-���������Ժ��������ʣ����������Ҵ�-ˮ��ϼ�ϴ�ӡ�����Ƽ�ʵ��֤��2-����-1��3-�������Ѿ�ϴ�Ӹɾ���______________��
��5����ʵ�����ջ��1.0g�ٻ�ɫ���壬��2-����-1��3-�����ӵIJ���ԼΪ____��
���𰸡� ���⸱����IJ��� ��ֹѹǿ��С������ �¶Ƚϸ�ʱ�����ֽ�(��������)�����ʹ��� ȡ���һ��ϴ����Һ�������μ�BaCl2��Һ��������������֤���Ѿ�ϴ�Ӹɾ� 12.9%
����������1���ɼ䱽������2-����-1��3-�����ӽṹ��֪����������ǰ�ߵ��������ǻ��м�����-NO2����ֱ�������������ȡ��-NO2�������ǻ����ڡ���λ�ϵ��⣬��3��λ�ã��������������-HSO3ռ��2��λ�ã�������-NO2ʱֻ����1��λ�ã������������Ŀ���DZ��⸱����IJ�������2����ƿA�в���������ѹ���ã����ܷ�ֹװ����ѹǿ���������¹ʣ����ܷ�ֹѹǿ��С����������3���¶ȸ���30����������Ľ���������ֽ������ǻ��ױ��������и���Ӧ���������ʹ��ͣ���4��������������ΪH2SO4��HNO3��ע�ⲻ�ܼ���pH����Ϊ2-����-1��3-�����ӳ����ԣ�����ֻ�ܼ���SO42-��ʵ��֤��2-����-1��3-�������Ѿ�ϴ�Ӹɾ���ʵ��Ϊ��ȡ���һ��ϴ����Һ�������μ�BaCl2��Һ��������������֤���Ѿ�ϴ�Ӹɾ�����5����ʵ�����ջ��1.0g�ٻ�ɫ���壬��2-����-1��3-�����ӵIJ���ԼΪ�� 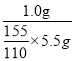 ��100%
��100%![]() 12.9%��
12.9%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ṹ��ʽΪ ��������������ȷ����(����)
��������������ȷ����(����)
A. 1 mol ���л����ڼ��Ⱥʹ��������£�����ܺ�4 mol H2��Ӧ
B. ���л�����ʹ��ˮ��ɫ��Ҳ��ʹ����KMnO4��Һ��ɫ
C. ���л�������������Һ������ɫ����
D. ���л�����һ���������ܷ�����ȥ��Ӧ��ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH3CH3��CH3CH2Cl��CH2=CH2��CH3CH2OH��ת�������У������ķ�Ӧ�����ǣ� ��
A.ȡ�����ӳɡ�����
B.�ӳɡ�ȡ������ȥ
C.ȡ������ȥ���ӳ�
D.ȡ������ȥ��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������X��Һ�ֱ�����ĸ�ʢ��10 mL 2 mol/L������ձ��У�����ˮϡ�͵�50 mL����ʱ��X�����Ỻ���ؽ��з�Ӧ�����з�Ӧ������(����)
A.10 �棬20 mL 3 mol/L ��X��Һ
B.20 �棬30 mL 2 mol/L��X��Һ
C.20 �棬10 mL 4 mol/L��X��Һ
D.10 �棬10 mL 2 mol/L��X��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ؽ���Ԫ�ظ��Ķ��Խϴ�����ˮ�辭������������ŷš�
������ij��ҵ��ˮ����Ҫ����Cr3+��ͬʱ������������Fe2+��Fe3+��Al3+��Ca2+��Mg2+�ȣ������Խ�ǿ��Ϊ�������ã�ͨ�������������̴�����
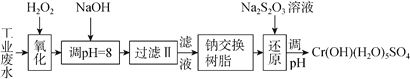
ע�����������ӳ�����������������ʽ��ȫ����ʱ��Һ��pH���±���
�������� | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(��9�ܽ�) |
��1�����������пɴ���H2O2������Լ���________�����������
A.Na2O2����B.HNO3����C.FeCl3����D.KMnO4
��2������NaOH��Һ������ҺpH=8ʱ����ȥ��������___�������������֪�����ӽ�����֬��ԭ����Mn++nNaRMRn+nNa+���˲�������������ȥ����������___�����������
A.Fe3+����B.Al3+����C.Ca2+����D.Mg2+
��3���ڻ�ԭ�����У�ÿ����172.8gCr2O72- ת��4.8mole-����ԭ�����и÷�Ӧ���ӷ���ʽΪ____������֪������������Cr3+ת��ΪCr2O72- ��
���������������£���Ԫ����Ҫ��Cr2O72-��ʽ���ڣ���ҵ�ϳ��õ�ⷨ������Cr2O72-�ķ�ˮ��ʵ����������ͼװ��ģ����÷�ˮ��������Ӧ��Fe-2e-![]() Fe2+��������Ӧʽ��2H++2e-
Fe2+��������Ӧʽ��2H++2e-![]() H2����
H2����
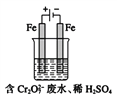
��1�����ʱ�ܷ���Cu�缫������Fe�缫��______������������������������������_____��
��2�����ʱ����������Һ��ת��ΪCr3+�����ӷ���ʽΪ___________________��
��3��������Ӧ�õ��Ľ������������������ɳ�����ȫ�������ˮ�ĵ���ƽ��Ӱ��ǶȽ�����ԭ��______________________��
��4������Һ�г�ʼ����0.1mol Cr2O72-�������ɵ�������ȫ��ת���ɳ�����������_______g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3.2gͭ����������ᣨ8mol/L��30mL����ַ�Ӧ������Ļ�ԭ������NO��NO2 �� ��Ӧ����Һ�к���amolH+ �� ���ʱ��Һ�к���NO3�������ʵ���Ϊ�� ��
A.��0.1+a��mol
B.��0.2+a��mol
C.��0.05+a��mol
D.amol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ�¡�ͬѹ�µ�������SO2�����CO2���壬�����йرȽϵ������У���ȷ���Ǣ��ܶȱ�Ϊ16��11 ���ܶȱ�Ϊ11��16 �������Ϊ16��11 �������Ϊ11��16�� ��
A.�٢�
B.�٢�
C.�ڢ�
D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���Ԫ�������ɣ��ж�������������ȷ����
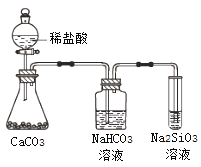
A. ��̬�⻯����ȶ��ԣ�H2O��NH3��SiH4
B. ��Ԫ��������Ԫ�ؿ��γɹ��ۻ���������ӻ�����
C. ��ͼ��ʾʵ���֤��Ԫ�صķǽ����ԣ�Cl��C��Si
D. ��������![]() ������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������N2��O2��CO2�������ͨ��������Na2O2��ͬ��ͬѹ�������Ϊԭ����0.75����ԭ���������N2��O2��CO2���ʵ���֮�ȿ���Ϊ
A.1��1��2B.4��3��5C.1��2��1D.6��7��14
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com