
【题目】肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1反应Ⅱ:N2H4(g)+H2(g)2NH3(g)ΔH2=-41.8 kJ·mol-1

下列说法不正确的是()
A. 图所示过程①是放热反应
B. 反应Ⅱ的能量过程示意图如图所示
C. 断开3 mol N2H4(g)的化学键吸收的能量大于形成1 molN2(g)和4 mol NH3(g)的化学键释放的能量
D. 200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g)ΔH=+50.7 kJ·mol-1
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O。
(1)用双线桥标出电子转移的方向和数目___。
(2)该反应中,氧化剂是___,还原剂是____。
Ⅱ.铜绿即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜),铜在潮湿的空气中生锈的化学反应为:2Cu+O2+CO2+H2O=Cu2(OH)2CO3。
(1)用单线桥标出电子转移的方向和数目____。
(2)该反应中的还原剂是____、氧化剂是____。
Ⅲ.氮化铝具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可以通过如下方式合成:Al2O3+N2+3C=2AlN+3CO
(1)用单线桥标出该反应中电子转移的方向和数目___。
(2)该反应中的还原剂是___、氧化剂是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置(Ⅰ)为铁镍(Fe﹣Ni)可充电电池:Fe+NiO2![]() Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图,当闭合开关 K 时,Y 附近溶液先变红.下 列说法正确的是( )
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图,当闭合开关 K 时,Y 附近溶液先变红.下 列说法正确的是( )

A. 闭合 K 时,X 的电极反应式为:2H++2e═H2↑
B. 给装置(Ⅰ)充电时,OH通过阴离子交换膜,移向 A 电 极
C. 给装置(Ⅰ)充电时,B 极参与反应的物质被氧化
D. 闭合 K 时,A 电极反应式为:NiO2 + 2e +2H+═Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A. 电子由电极A经外电路流向电极B
B. 该电池工作时,每消耗22.4L NH3转移3mol电子
C. 电池工作时,OH-向电极B移动
D. 电极B上发生的电极反应为:O2+ 4H++ 4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是
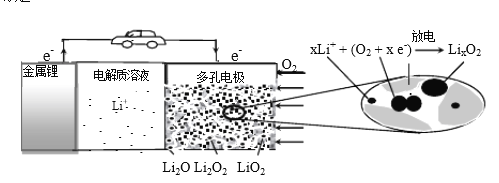
A. 该电池工作时Li+向负极移动
B. Li2SO4溶液可作该电池电解质溶液
C. 电池充电时间越长,电池中Li2O 含量越多
D. 电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液中滴加NaOH溶液,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是()

A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 从a点开始滴入NaOH溶液,溶液中c(H+)/c(H2A)先减小后增大
C. 将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
D. pH从3.00到5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同情况下测得A(g)+3B(g)![]() 2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 molL-1s-1 B. υ(C)=0.010 molL-1s-1
C. υ(B)=0.6 molL-1min-1 D. υ(A)=0.2molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
下列说法正确的是
A. 增加高炉的高度可以有效降低炼铁尾气中CO的含量
B. 由表中数据可判断该反应:反应物的总能量>生成物的总能量
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO表示该反应的平均速率为![]() mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.Fe(CO)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂.据此可以判断Fe(CO)5晶体类型为__。
(2)科学家通过X射线探明,MgO、CaO的晶体结构与NaCl晶体结构相似(如图所示)

①比较晶体熔点的高低MgO__CaO(填“高于”或“低于”),
②Mg2+的配位原子所构成的立体几何构型为__,③MgCO3晶格能大于CaCO3,为何MgCO3更易分解__。
(3)Ni的堆积与MgO中氧原子堆积相同,Ni可以吸附H2,氢以单个原子形式填入四面体空隙,则Ni最大量吸收H2后,n(Ni):n(H)=__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com