
【题目】Ⅰ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O。
(1)用双线桥标出电子转移的方向和数目___。
(2)该反应中,氧化剂是___,还原剂是____。
Ⅱ.铜绿即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜),铜在潮湿的空气中生锈的化学反应为:2Cu+O2+CO2+H2O=Cu2(OH)2CO3。
(1)用单线桥标出电子转移的方向和数目____。
(2)该反应中的还原剂是____、氧化剂是____。
Ⅲ.氮化铝具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可以通过如下方式合成:Al2O3+N2+3C=2AlN+3CO
(1)用单线桥标出该反应中电子转移的方向和数目___。
(2)该反应中的还原剂是___、氧化剂是____。
【答案】 KIO3 KI
KIO3 KI 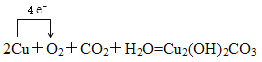 Cu O2
Cu O2 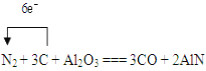 C N2
C N2
【解析】
Ⅰ.KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,KIO3中碘元素化合价由+5降低为0,KI中氮元素化合价由-1升高为0;
Ⅱ.反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3,Cu元素化合价由0升高为+2,O2中O元素化合价由0降低为-2;
Ⅲ. Al2O3+N2+3C=2AlN+3CO,N2中N元素化合价由0降低为-3,C元素化合价由0升高为+2;
Ⅰ.(1)KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,KIO3中碘元素化合价由+5降低为0,KI中氮元素化合价由-1升高为0,电子转移的方向和数目是 ;
;
(2)所含元素化合价降低的反应物为氧化剂,所含元素化合价升高的反应物为还原剂,KIO3中碘元素化合价由+5降低为0,所以KIO3是氧化剂;KI中氮元素化合价由-1升高为0,所以KI是还原剂;
Ⅱ. (1)反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3,Cu元素化合价由0升高为+2,O2中O元素化合价由0降低为-2,电子转移的方向和数目是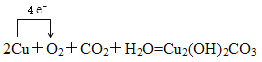 ;
;
(2)所含元素化合价降低的反应物为氧化剂,所含元素化合价升高的反应物为还原剂,Cu元素化合价由0升高为+2,所以Cu是还原剂;O2中O元素化合价由0降低为-2,所以O2是氧化剂;
Ⅲ. (1)反应Al2O3+N2+3C=2AlN+3CO,N2中N元素化合价由0降低为-3,C元素化合价由0升高为+2,电子转移的方向和数目是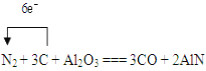 ;
;
(2)所含元素化合价降低的反应物为氧化剂,所含元素化合价升高的反应物为还原剂,C元素化合价由0升高为+2,所以C是还原剂;N2中N元素化合价由0降低为-3,所以N2是氧化剂;


科目:高中化学 来源: 题型:
【题目】在25℃时,H2R的钠盐溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(ɑ)随溶液pH变化关系如图所示,下列叙述不正确的是

A. H2R属于二元弱酸
B. pH=8时,溶液中c(Na+)>c(R2-)>c(HR-)>c(OH-)>c(H+)
C. 若c(H2R)+2c(R2-)+c(OH-)=c(H+),则pH一定小于2
D. 配制c(R2-)=c(HR-)的钠盐溶液应控制溶液的pH=7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:

(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mgL-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05 molL-1 NaClO溶液________L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。电池工作时的总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,则下列说法正确的是
Li1-xFePO4+LixC6,则下列说法正确的是

A. 图中聚合物隔膜是阴离子交换膜;
B. 充电时,Li+ 迁移方向是“由右向左”
C. 放电时,正极的电极反应式为LiFePO4—xe- = Li1-xFePO4 + xLi+
D. 用该电池电解精炼铜,当转移电子1.25mol时能得到精铜32g,则电子利用率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铜锌原电池示意图,下列说法正确的是

A. 锌片逐渐溶解 B. 烧杯中溶液逐渐呈蓝色
C. 电子由铜片通过导线流向锌片 D. 该装置能将电能转变为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用15.8g高锰酸钾氧化密度为1.19g/cm3、质量分数为36.5%的盐酸以制取氯气。反应如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积?____
(2)求盐酸的浓度?____
(3)如果恰好完全反应,求所需盐酸的体积?____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应:A2(g)+3 B2(g)![]() 2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
A.Q2 = 2 Q1 B.2Q1 < Q2
C.Q1 < Q2 < 92.4 kJ D.Q1 = Q2 < 92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D分别是盐酸、碳酸钠、氯化钙、硝酸银四种溶液中的一种。将它们两两混合后,观察到的现象如表所示(“↓”表示生成沉淀,“↑”表示生成气体,“——”表示不反应)。请据此回答:

(1)写出A、B、C溶液中溶质的名称或化学式:
A__ B___ C____
(2)C和D反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1反应Ⅱ:N2H4(g)+H2(g)2NH3(g)ΔH2=-41.8 kJ·mol-1

下列说法不正确的是()
A. 图所示过程①是放热反应
B. 反应Ⅱ的能量过程示意图如图所示
C. 断开3 mol N2H4(g)的化学键吸收的能量大于形成1 molN2(g)和4 mol NH3(g)的化学键释放的能量
D. 200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g)ΔH=+50.7 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com