
【题目】下列电离方程式中,正确的是( )
A. H2SO4===H2++SO42- B. Ba(OH)2===Ba2++OH﹣
C. NaNO3===Na++NO3- D. CuSO4===Cu+2+SO4-2
科目:高中化学 来源: 题型:
【题目】食用二氧化硫漂白过的食品,对人体的肝、肾脏等有严重损害。某科研小组设计实验检验二氧化硫的漂白性。回答下列问题:
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫:


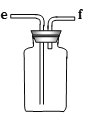
A B C D E
(1)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:________(按气流方向,用小写字母表示)。
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。
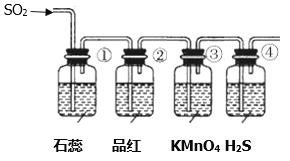
(2)根据上述实验,回答下列问题:
序号 | 实验现象 | 解释原因 |
① | _________________________ | _________________________ |
② | 品红试液褪色 | SO2具有漂白性 |
③ | ________________________ | 反应的离子方程式____________________ |
④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
(3)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0g Na2SO3样品,配成250mL溶液,取25.00mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00mL。达到滴定终点时锥形瓶中溶液颜色变化是________________________,样品中Na2SO3质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g )![]() CO2(g)+H2(g)在427℃时的平衡常数是9,如果反应开始时,一氧化碳和水蒸气的浓度都为1mol/L,5min达到平衡。计算:
CO2(g)+H2(g)在427℃时的平衡常数是9,如果反应开始时,一氧化碳和水蒸气的浓度都为1mol/L,5min达到平衡。计算:
(1)从反应开始到达到平衡时用H2表示的反应速率__________。
(2)CO的转化率___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热ΔH=-3677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法不正确的是()
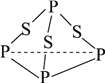
A. 分子中每个原子最外层均达到8电子稳定结构
B. P4S3中硫元素为-2价,磷元素为+3价
C. 一个P4S3分子中含有三个非极性共价键
D. 热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的外成层电子数相同。
(1)Z离子的结构示意图是_____________________________。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是_______,其中含有的化学键有__________________。
(3)X与Y所形成的分子的电子式为__________,它比同主族其他元素的氢化物沸点高的原因是__________________。
(4)请从Z、W的结构上说明Z、W两种元素非金属性的强弱_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释正确的是( )
A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B.分别用盛满HCl气体和盛满NO2气体的烧瓶做喷泉实验,喷泉结束后,所得溶液的物质的量浓度相同
C.向50 mL 18 molL﹣1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(g)![]() 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
①C的生成速率与C的分解速率相等②单位时间生成amolA,同时消耗1.5molB;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2: 3: 2.
A. ⑤⑥⑧ B. ②⑤⑧ C. ①③④ D. ②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氧化还原反应Zn+2H+=Zn2++H2↑设计一个原电池?并判断正负极、写出各电极电极反应方程和反应的类型(在方框内画出原电池装置图) 负极:
正极:
负极反应:
正极反应:
负极反应类型:
正极反应类型:
原电池装置图: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com