
【题目】食用二氧化硫漂白过的食品,对人体的肝、肾脏等有严重损害。某科研小组设计实验检验二氧化硫的漂白性。回答下列问题:
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫:


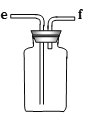
A B C D E
(1)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:________(按气流方向,用小写字母表示)。
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。
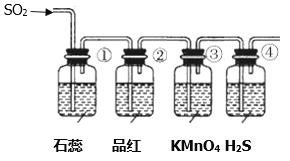
(2)根据上述实验,回答下列问题:
序号 | 实验现象 | 解释原因 |
① | _________________________ | _________________________ |
② | 品红试液褪色 | SO2具有漂白性 |
③ | ________________________ | 反应的离子方程式____________________ |
④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
(3)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0g Na2SO3样品,配成250mL溶液,取25.00mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00mL。达到滴定终点时锥形瓶中溶液颜色变化是________________________,样品中Na2SO3质量分数是_______。
【答案】 b→c→d→e→f→g 石蕊试液变红 石蕊试液变红说明SO2是酸性气体 KMnO4溶液颜色褪色(“褪色”写成“变浅”也可酌情给分) 5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+ 由无色变为紫红色 84%
【解析】(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,悬着装置A制备二氧化硫,再用浓硫酸干燥后收集,为干燥彻底,所以b连接C装置的c,二氧化硫密度比空气大,所以收集时导气管应长进短出,二氧化硫为有害气体,所以应用氢氧化钠吸收多余的二氧化硫气体,则连接顺序为:b→c→d→e→f→g,故答案为:b→c→d→e→f→g;
(2)二氧化硫为酸性气体,所以能使①中石蕊试液变红,具有漂白性,能使②中品红溶液褪色,具有还原性,发生反应5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+,能使③中酸性高锰酸钾褪色,具有氧化性,能与④中硫化钠发生价态归中反应生成硫单质,SO2+2H2S=3S↓+2H2O,④中溶液浑浊,生成淡黄色沉淀;故答案为:石蕊试液变红;石蕊试液变红说明SO2是酸性气体;KMnO4溶液颜色褪色;5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+
(3)酸性KMnO4溶液进行滴定亚硫酸钠溶液,滴入最后一滴,溶液呈紫红色且半分钟不变化,证明反应达到终点,用高锰酸钾滴定亚硫酸钠,依据方程式得:
5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O
5 2
n 0.20mol/L×0.02L
则:5:2=n:0.20mol/L×0.02L
解得n=0.01mol,则15.0g样品中含有亚硫酸的质量为0.01mol×10×126g/mol=12.6g,所以样品中亚硫酸钠的质量分数为![]() ×100%=84%;故答案为:由无色变为紫红色;84%。
×100%=84%;故答案为:由无色变为紫红色;84%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】据研究,若把太阳光变成激光用于分解海水制氢,反应可表示为:2H2O ![]() H2↑+O2↑.有下列几种说法: ①水分解反应是放热反应;
H2↑+O2↑.有下列几种说法: ①水分解反应是放热反应;
②氢气是可再生能源;
③使用氢气作燃料有助于控制温室效应;
④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件.其中叙述正确的是( )
A.①②
B.③④
C.②③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 二氧化硫有毒,严禁将其添加到任何食品和饮料中
B. 用排空气法收集NO
C. 用加热浓氨水的方法可以快速制氨气,经氯化钙干燥后得到纯净的氨气
D. 8NH3+3Cl2=6NH4Cl+N2,因此可以用浓氨水检验氯气的管道是否漏气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积数据:

试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”),作此判断的理由是______。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L﹣1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=__________。
(3)在t2℃下,pH=10的NaOH溶液中,水电离产生的OH-为浓度为_________。
(4)t2℃下,将pH=11的NaOH溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=________。
(5)有H+浓度相同、体积相等的三种酸:a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率大小顺序为_____;反应完全后生成H2的质量大小关系为____(用abc表示酸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示真核细胞某些结构的主要组成成分(字母是元素符号),下列叙述正确的是( )

A. 结构1功能的复杂程度主要是由图中乙的种类和数量直接决定的
B. 物质乙、丙的单体分别是氨基酸和核糖核苷酸
C. 原核细胞无结构1,但含有乙、丙物质
D. 该真核细胞的遗传物质主要是丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,最终的白色沉淀不一定是BaSO4的是( )
A.Ba(NO3)2溶液 ![]() 白色沉淀
白色沉淀
B.无色溶液 ![]()
![]() 白色沉淀
白色沉淀
C.Ba(NO3)2溶液 ![]() 无现象
无现象 ![]() 白色沉淀
白色沉淀
D.Fe(NO3)2溶液 ![]()
![]()
![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应不属于置换反应而属于氧化还原反应的是( )
A.CuO+CO ![]() Cu+CO2
Cu+CO2
B.Fe+H2SO4═FeSO4+H2↑
C.3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
D.4NH3+3O2 ![]() 2N2+6H2O
2N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)烧杯间填满碎纸条的作用是________________________;
(3)大烧杯上如不盖硬纸板,求得的中和热数值_____(填“偏大”“偏小”“无影响”);
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),简述理由______________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A. H2SO4===H2++SO42- B. Ba(OH)2===Ba2++OH﹣
C. NaNO3===Na++NO3- D. CuSO4===Cu+2+SO4-2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com