
【题目】恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(g)![]() 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
①C的生成速率与C的分解速率相等②单位时间生成amolA,同时消耗1.5molB;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2: 3: 2.
A. ⑤⑥⑧ B. ②⑤⑧ C. ①③④ D. ②④⑦
【答案】A
【解析】试题分析:① C的生成速率与C的分解速率相等,则C的浓度不变,反应达到平衡状态,错误;②单位时间生成amol A,同时会产生1.5amol B,还同时消耗1.5amol B,则反应处于平衡状态,错误;③各组分的浓度不再变化,则物质的总物质的量不变,反应处于平衡状态,错误;④由于是恒温恒容,反应前后物质的质量发生改变,若混合气体的密度不再变化,则任何气体的质量不变,气体的物质的量不变,反应处于平衡状态,错误;⑤该反应是反应前后气体体积不变的反应,在任何时刻混合气体的总压强都再变化,因此不能据此判断反应处于平衡状态,正确;⑥该反应是反应前后气体的物质的量不变的反应,因此在任何时刻混合气体的物质的量都不变,因此不能据此判断反应处于平衡状态,正确;⑦该反应反应前后气体的质量发生变化,而气体的物质的量不变,因此若混合气体的平均摩尔质量不再变化,说明反应处于平衡状态,错误;⑧A、B、C的分子数目比为2:3:2,反应可能处于平衡状态,也可能不处于平衡状态,这与开始加入的物质的量的多少及反应条件有关,错误。因此符合题意的是⑤⑥⑧,选项A正确。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)烧杯间填满碎纸条的作用是________________________;
(3)大烧杯上如不盖硬纸板,求得的中和热数值_____(填“偏大”“偏小”“无影响”);
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),简述理由______________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A. H2SO4===H2++SO42- B. Ba(OH)2===Ba2++OH﹣
C. NaNO3===Na++NO3- D. CuSO4===Cu+2+SO4-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A处通入干燥Cl2 , 关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( ) 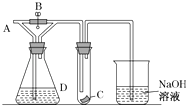
A.浓H2SO4
B.NaOH溶液
C.浓盐酸
D.饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中a、b、c表示相应仪器中加人的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列各组离子能大量共存的是( )
A. Fe2+、K+、Cl-、NO3- B. Ag+、Na+、NO3-、Cl-
C. Zn2+、Al3+、SO42-、Cl- D. Ba2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g)![]() 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强 | P1 | P2 | P3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2 c1>c3 B. a + b=92.4 C. 2P1<P3 D. α1 +α3=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图实验装置验证通过改变浓度来实现反应2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是

A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
D. 当b极有0.001 mol Fe3+被还原时,则通过盐桥的电子数为0.001 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com