
����Ŀ��ijͬѧ����ͼʵ��װ����֤ͨ���ı�Ũ����ʵ�ַ�Ӧ2Fe3++2I-��2Fe2+��I2��Fe3+��Fe2+���ת����K�պ�ʱ��������ָ���һ�η���ƫת����ָ����������ܵμ�0.01mol/L��AgNO3��Һ������ָ��ڶ���ƫת�������෴�������й�˵������ȷ����

A. ָ���һ��ƫתʱ��b����ӦʽΪFe3+��e-��Fe2+
B. ����AgNO3��a����
C. �ڶ���ָ��ƫת��ԭ���ǣ�I-Ũ�ȼ�С����Ӧ�������
D. ��b����0.001 mol Fe3+����ԭʱ����ͨ�����ŵĵ�����Ϊ0.001 NA
 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪һ����̼��ˮ�����ķ�ӦΪ��CO(g)��H2O(g )![]() CO2(g)��H2(g)��427��ʱ��ƽ�ⳣ����9�������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ�Ϊ1mol/L,5min�ﵽƽ�⡣���㣺
CO2(g)��H2(g)��427��ʱ��ƽ�ⳣ����9�������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ�Ϊ1mol/L,5min�ﵽƽ�⡣���㣺
��1���ӷ�Ӧ��ʼ���ﵽƽ��ʱ��H2��ʾ�ķ�Ӧ����__________��
��2��CO��ת����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º��������£����������в��ǿ��淴Ӧ2A��g��+3B��g��![]() 2C��g���ﵽƽ��ı�־����
2C��g���ﵽƽ��ı�־����
��C������������C�ķֽ������������λʱ������amolA��ͬʱ����1.5molB��������ֵ�Ũ�Ȳ��ٱ仯�������������ܶȲ��ٱ仯��������������ѹǿ���ٱ仯���������������ʵ������ٱ仯������������ƽ��Ħ���������ٱ仯����A��B��C�ķ�����Ŀ��Ϊ2: 3: 2.
A. �ݢޢ� B. �ڢݢ� C. �٢ۢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯�������Һ����ת����ϵ����֪����B2��C2��D2��E2�ڳ��³�ѹ�¶������壬������G����ɫ��ӦΪ��ɫ��������I��J��Kͨ��״���³���̬������˵����ȷ����
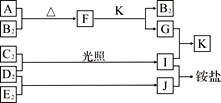
A. B�⻯��ķе������ͬ��������Ԫ���⻯��ķе�
B. ԭ�Ӱ뾶��С��A��C��B��E��D
C. F�мȺ������Ӽ��ֺ��м��Թ��ۼ�
D. G�е�������������ˮ�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��ͭ�������л�������ɱ�����������ͭ�����Ӽ������������̻���������졣CuSO4��Һ��Na2CO3��Һ��Ӧ�ܷ�õ���ʽ̼��ͭ��ij��ͬѧ�������̽����
�������Ʊ���ȡһ����������CuSO4��5H2O������ˮ���ٵμ���ϡ���ᣬ��ֽ����õ�һ�������CuSO4��Һ�������м�����Na2CO3��Һ������������ɫ����Һ���ˣ�������ˮϴ�ӣ�������ˮ�Ҵ�ϴ�ӡ�
��1���μ�ϡ�����������________��
��2������ˮ�Ҵ�ϴ�ӵ�Ŀ����________��
��ʵ��̽����ͬѧ�����������װ�ã����Ƶõ�����ɫ�������ʵ�飺
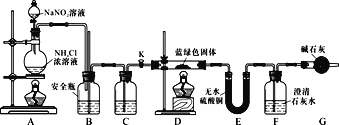
��3��Dװ�ü���ǰ����Ҫ���ȴ���K����Aװ����ȡ����N2��Ȼ��ر�K����ȼD���ƾ��ơ�A�в�����N2��װ���еĿ����ų���������š�C��ʢװ���Լ�Ӧ��________��
��4��װ��A�з�����Ӧ�����ӷ���ʽΪ________��
��5��������ɫ��������ΪxCuCO3��yCu(OH)2��ʵ���ܹ۲쵽��������________��
��6��ͬѧ�Dz�������֪��Ksp(CaCO3)��2.8��10��9��Ksp(BaCO3)��5.1��10-9����������Ϊ��Ҫ��Ba(OH)2����Ca(OH)2�������ⶨ����ɫ����Ļ�ѧʽ����ԭ����________��
a��Ba(OH)2�ļ��Ա�Ca(OH)2ǿ
b��Ba(OH)2�ܽ�ȴ���Ca(OH)2���ܳ������CO2
c����ͬ�����£�CaCO3���ܽ�����Դ���BaCO3
d�����յ���CO2���ɵ�BaCO3����������CaCO3���������С
��D�з�Ӧ��ȫ����K���ٴεμ�NaNO2��Һ����N2����Ŀ����________��������������ȡ����ɫ��������Ϊ27.1 g��װ��F��ʹ��Ba(OH)2��Һ��ʵ�������װ��E����������2.7 g��F�в�������19.7 g���������ɫ����Ļ�ѧʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��Һ���ܴ����������������
A. Al3+ H+ HCO3�� Cl�� B. Na+ AlO2�� OH�� SO42��
C. Ca2+ K+ NO3�� CO32�� D. H+ Fe2+ MnO4�� NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��ӦZn+2H+=Zn2++H2�����һ��ԭ��أ����ж���������д�����缫�缫��Ӧ���̺ͷ�Ӧ�����ͣ��ڷ����ڻ���ԭ���װ��ͼ�� ������
������
������Ӧ��
������Ӧ��
������Ӧ���ͣ�
������Ӧ���ͣ�
ԭ���װ��ͼ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ֱ��ʾ�������ڵ��������ӵIJ��ֽṹģʽͼ����ͼ�ش�
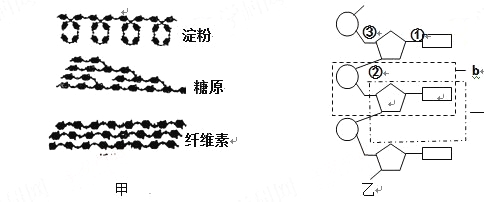
��1����ͼ�е��������ʶ��������� ���Ӷ��ɵģ���������ֲ��ϸ���еĴ��������� �������������У��ڹ��������������ֽ�Ȼ��ͬ���� ��������
�ʲ���ϸ���� �Ĺ��ɡ�
��2����ͼ��ʾ������Ļ�����ɵ�λ����ͼ����ĸ ��ʾ����������λ֮����ͨ�� �������������������������ġ�
��3����b�γɵĶ�����ܴ���������Ŵ���Ϣ��ԭ���� �����з�ʽ�Ƕ����ġ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������
��1��Zn����ϡ���ᷴӦһ��ʱ���Ӧ���ʻ�����������Ȼ����Ũ�����Ӧ�������Լӿ죮�ɴ��жϣ�Ӱ�컯ѧ��Ӧ���ʵ���������
��2��Ϊ̽��п�����ᷴӦ���̵����ʱ仯��ijͬѧ��ʵ��ⶨ�����ǣ���100mlϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£���������ѻ���Ϊ��״������
ʱ��/min | 1 | 2 | 3 | 4 | 5 |
���/mL | 50 | 120 | 232 | 290 | 310 |
����һʱ��η�Ӧ����������0��1min����1��2min����2��3min����3��4min����4��5min������
��2��3minʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ���ʣ�����Һ������䣩Ϊ ��
���Է���1��3minʱ������Ӧ���ʱ�����Ҫԭ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com