
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | |||||||||||||||
| a | b | c | d | ||||||||||||||
 ,酸性最强的是HClO4,属于两性氢氧化物的是Al(OH)3,
,酸性最强的是HClO4,属于两性氢氧化物的是Al(OH)3, ;HClO4;Al(OH)3;
;HClO4;Al(OH)3; 

 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
| A、氢氧化钡与稀硫酸混合:SO42-+H++OH-+Ba2+=H2O+BaSO4↓ |
| B、碳酸氢钠溶液与NaOH溶液混合:HCO3-+OH-=H2O+CO32- |
| C、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| D、氧化铜与盐酸反应 O2-+2H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
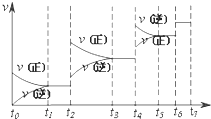 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫的化合物在生产和科研中发挥着重要作用.
硫的化合物在生产和科研中发挥着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
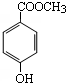 分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途.
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com