
| m |
| M |
| V |
| Vm |
| n |
| V |
| 1000ρw |
| M |
| V |
| Vm |
| m |
| n |
| m |
| M |
| 33.6L |
| 22.4L/mol |
| 1.5mol |
| 1L |
| 1000ρw |
| M |
| 1000×1.4×49% |
| 98 |
| 4.48L |
| 22.4L/mol |
| 14.2g |
| 0.2mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、150.0mL 1.0 mol/L NaCl溶液 |
| B、75.0mL 2.0 mol/L MgCl2溶液 |
| C、150.0mL 2.0 mol/LKCl溶液 |
| D、75.0 mL 1.0 mol/L A1C13溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
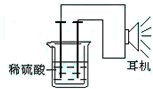 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | |||||||||||||||
| a | b | c | d | ||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
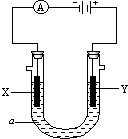 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定含有的离子种类 | |||||||
| 物质的量浓度(mol/L) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com