
【题目】下图装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:

(1)c极的电极反应式为_________。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,电解进行一段时间后,你能观察到的现象是:___________, 电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应式为_____________。
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了____moL气体,此时若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为_________。此时A池中溶液pH为_________。(假设电解前后A池溶液体积无变化,数据化成最简形式即可)
【答案】 2I—-2e-=I2 C极附近溶液变为蓝色 4OH——4e-=2H2O+O2 0.001 108g/mol 2-lg2
【解析】由电解原理可得:金属M沉积于b极,说明b是阴极,则a是阳极,c是阳极,d是阴极,(1)因c是阳极,溶液中的阴离子放电,根据离子的放电顺序,可知是2I--2e-=I2;(2)在B烧杯中, c是阳极,溶液中的阴离子放电,即2I--2e-=I2,I2遇到淀粉能使淀粉变蓝,电解进行一段时间后,I-放电完毕后,接着是OH-放电,罩在c极上的试管中也收集到了气体,此时c极上的电极反应式为:4OH--4e-=2H2O+O2↑;(3)d电极上收集的44.8ml气体(标准状况)是氢气,a极上收集到的气体是氧气,根据转移电子数相等知,氧气和氢气的体积之比是1:2,d电极上收集的44.8ml气体氢气,则a电极上收集到22.4mL氧气;物质的量为0.001mol,d电极上析出的氢气的物质的量=![]() =0.002mol,转移电子的物质的量是0.004mol,硝酸盐中M显+1价,所以当转移0.004mol电子时析出0.004mol金属单质,M=
=0.002mol,转移电子的物质的量是0.004mol,硝酸盐中M显+1价,所以当转移0.004mol电子时析出0.004mol金属单质,M=![]() =108g/mol; A池中a是阳极,阳极上氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑,根据转移电子数相等知,转移电子的物质的量是0.004mol,则产生的氢离子的物质的量为0.004mol,c(H+)=
=108g/mol; A池中a是阳极,阳极上氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑,根据转移电子数相等知,转移电子的物质的量是0.004mol,则产生的氢离子的物质的量为0.004mol,c(H+)=![]() =2.0×10-3mol/L,pH=- lg c(H+)=2-lg2。
=2.0×10-3mol/L,pH=- lg c(H+)=2-lg2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某弱酸溶液中存在电离平衡HA![]() H++A-,下列叙述不正确的是
H++A-,下列叙述不正确的是
A. 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-)
B. 0.10 mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 常温下,加入NaA固体可使HA的电离常数变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关高分子化合物性质的描述不正确的是( )
A.一般具有良好的绝缘性B.均不溶于水,易溶与有机溶剂
C.均不耐热,受热后会熔化改变原有形状D.一般比同质量金属强度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
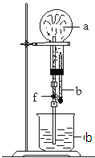
a(干燥气体) | b(液体) | |
① | NO2 | 水 |
② | CO2 | 4molL-1NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NH3 | l molL-1盐酸 |
A. ①和② B. ③和④ C. ①和③ D. ②和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种高效清洁的可再生能源,请回答:
(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:_____________。
(2)氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,若电解质溶液为KOH,则负极上的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下KMnO4氧化浓HCl的反应方程式如下:
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(1)用“双线桥法”标明反应中电子转移的方向和数目.
(2)又已知MnO2+4HCl(浓) ![]() MnCl2+Cl2+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
MnCl2+Cl2+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
(3)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为mol,产生的Cl2在标准状况下的体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373k时,把11.5gN2O4气体通入体积为500mL的真空密闭容器中,立即出现红棕色的NO2气体,反应原理为N2O4![]() 2NO2。当反应进行到2s时,NO2含量为0.01mol,反应进到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍。试通过计算填空:
2NO2。当反应进行到2s时,NO2含量为0.01mol,反应进到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍。试通过计算填空:
(1)开始2s内,以N2O4表示的反应速率为___mol·L-1·s-1。
(2)达到平衡时,体系的压强是开始时的____倍。
(3)平衡时还有_______mol N2O4。
(4)平衡后若压缩容器体积,则再达到平衡后NO2的浓度将_______(填“增大”、“减少”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com