
分析 ①根据配制一定物质的量浓度溶液的实验步骤确定操作所需仪器;
②分析操作对溶质的物质的量和溶液体积的影响,根据c=$\frac{n}{V}$进行误差分析,凡是使溶质的物质的量偏大或者溶液体积偏小的操作,溶液浓度都偏高,据此解答.
解答 解:①配制100mL 1.000mol/L的稀硫酸,可用量筒量取一定体积的浓硫酸,在烧杯中加水稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,并洗涤烧杯,将洗涤液一并转移到容量瓶中,加入蒸馏水至刻度线2~3cm时,改用教头滴管定容,则还需要的仪器有玻璃棒和100mL容量瓶,
故答案为:⑦⑧;
②A.量取浓H2SO4时,俯视刻度线,会导致量取液体体积偏小,浓度偏低,故A错误;
B.定容时,俯视容量瓶刻度线,会导致体积偏小,浓度偏大,故B正确;
C.配制前,容量瓶中有水珠,对实验没有影响,故C错误;
D.定容后摇匀发现液面下降而未向其中再加水,浓度没有影响,故D错误;
故答案为:B.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理及操作对溶质的物质的量和溶液体积的影响是解题关键,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:实验题
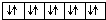
 利用如图所示的装置和其他必要的仪器用品,完成下列实验.
利用如图所示的装置和其他必要的仪器用品,完成下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
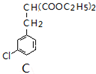 $\underset{\stackrel{①O{H}^{-},②{H}_{3}{O}^{+}}{→}}{③△}$D$\stackrel{SOCl_{2}}{→}$
$\underset{\stackrel{①O{H}^{-},②{H}_{3}{O}^{+}}{→}}{③△}$D$\stackrel{SOCl_{2}}{→}$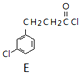 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$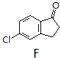
 或
或 (任写一种).
(任写一种). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第 IA族元素都是碱金属元素 | |
| B. | 元素原子的最外层电子数等于它的族序数 | |
| C. | 最外层电子数相同的元素不一定在同一个族 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=3 y=l | B. | x=4 y=1 | C. | x=5 y=1 | D. | x=2 y=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氯化苄是一种无色或微黄色的透明液体,是一种重要的化工、医药中间体.它的结构如图所示,则氯化苄完全氢化后所得到的有机物质在核磁共振氢谱图中有多少个吸收峰( )
氯化苄是一种无色或微黄色的透明液体,是一种重要的化工、医药中间体.它的结构如图所示,则氯化苄完全氢化后所得到的有机物质在核磁共振氢谱图中有多少个吸收峰( )| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题




查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.12mol/(L•min) | B. | 0.18 mol/(L•min) | C. | 1.8 mol/(L•min) | D. | 1.2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的比例模型: | |
| B. | N2H4的电子式为: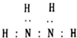 | |
| C. | NaH中氢离子结构示意图为: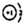 | |
| D. | 质子数是82,中子数是122的铅原子:${\;}_{82}^{122}$Pb |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com