
【题目】图1和图2是A、B两种物质的核磁共振氢谱。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质的分子式( )
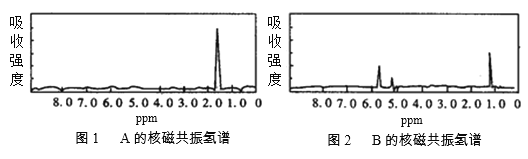
A.A是C3H6、B是C2H6
B.A是C6H6、B是C4H6
C.A是C6H6、B是C2H6
D.A是C3H8、B是C6H6
【答案】B
【解析】
核磁共振氢谱中峰数目等于H的种类数目。图1中只有一个峰,说明该分子中H的化学环境相同,即只有一种H,结合选项可知A可能为乙烷(C2H6)、苯(C6H6)或环丙烷(![]() );图2中有三个峰,说明该分子中有三种H,且个数之比为2:1:3,结合选项可知B可能为丙烯(CH2=CH-CH3),分子式为C3H6,或丁炔(CH
);图2中有三个峰,说明该分子中有三种H,且个数之比为2:1:3,结合选项可知B可能为丙烯(CH2=CH-CH3),分子式为C3H6,或丁炔(CH![]() CCH2CH3),分子式为C4H6。
CCH2CH3),分子式为C4H6。
A. 若C3H6为环丙烷,则有一种峰,符合图1;C2H6只能为乙烷,只有一种峰,不符合图2,A不合题意;
B.若C6H6为苯,只有一种峰,符合图1;若C4H6为1-丁炔,则有三种峰,符合图2,B符合题意;
C. 若C6H6为苯,只有一种峰,符合图1;C2H6只能为乙烷,只有一种峰,不符合图2,C不合题意;
D. C3H8只能为丙烷,有二种峰,不符合图1,D不合题意。
故选B。


科目:高中化学 来源: 题型:
【题目】已知pC=-lgc(B),室温下,某二元酸(H2A)中部分微粒的pC值随溶液pH值变化关系如图所示。下列说法错误的是( )
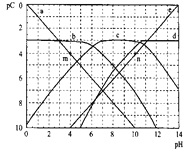
A.曲线a表示的微粒是H+
B.溶液中水的电离程度:m>n
C.pH=8时,溶液中,c(HA-)>c(H2A)
D.pH=1与pH=3时,H2A的浓度几乎相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6] 目前广泛用作食品添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg/kg。一种制备黄血盐的工艺如下:
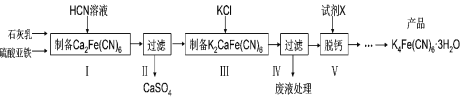
回答下列问题:
(1)步骤I反应的化学方程式为______。
(2)步骤IV过滤所得的废液中含量较多的溶质为______(填化学式)。
(3)步骤V是将难溶的K2CaFe(CN)6与X反应脱钙生成K4Fe(CN)6,所用的试剂X是_____。(填名称)
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
①25°C时Ka(HCN)=6.25×10-10;计算25℃时0.01molL-1的HCN溶液的pH=____(lg2.5=0.4)。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN;第二步控制pH为7.58.5,用NaClO溶液完全氧化OCN生成N2和两种盐(其中一种为酸式盐)。
第一步控制强碱性的主要目的是_______,第二步反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O35H2O,M=248g/mol)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体,具体流程如图:

回答下列问题:
(1)吸硫装置如图所示。装置B的作用是检验装置A中SO2的吸收效率,表明SO2吸收效率低的实验现象是_____。

(2)市售硫代硫酸钠中常含有硫酸钠杂质,选用下列试剂设计实验方案进行检验:试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液、无氧蒸镏水,完成下列操作:
实验操作 | 现象 | 结论 |
取少量样品于试管中,加入无氧蒸馏水 | 固体完全溶解 | |
往试管中加入_____ | _______,有刺激性气体产生 | 试样中含有硫代硫酸钠 |
静置,取上层清液,滴加_______ | ______________ | 试样含有硫酸根 |
(3)测定硫代硫酸钠的纯度步骤如下:
①溶液配制:准确取5.0000g产品,配制成250mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除_____及二氧化碳。
②滴定:向锥形瓶中加入25.00mL0.01mol/LKIO3溶液,加入过量KI溶液和H2SO4溶液,发生反应:IO3-+5I-+6H+ =3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2S2O32-=S4O62-+2I-。当_____,即为终点。消耗样品溶液的用量为20.00mL,则样品纯度为_____%(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
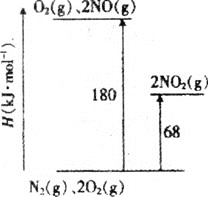
【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2molNO2的能量变化)。1molNO氧化为NO2的焓变ΔH=___。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K=6.7×1016
b.2NO(g)N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___(填“a”或“b”);反应2NO(g)+O2(g)2NO2(g)的K=___(保留三位有效数字)。
(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
起始浓度/molL-1 | |||
组别 | NO | O2 | 初始速率 /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0 0125 | 31.92×10-3 |
则k1=___,m=___,n=___。
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是___(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第一步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如图变化。
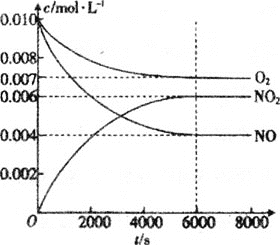
①NO的平衡转化率为___。
②该温度下反应2NO(g)+O2(g)2NO2(g)的平衡常数为___(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中现象及得出的结论正确的是( )
实验 | 现象 | 结论 | |
A |
| 试管(1)中紫色褪去,试管(2)中紫色未褪 | 苯环使甲基的活性增强 |
B |
| 试管内壁有银镜生成 | 有机物X中一定是醛 |
C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
D |
| 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
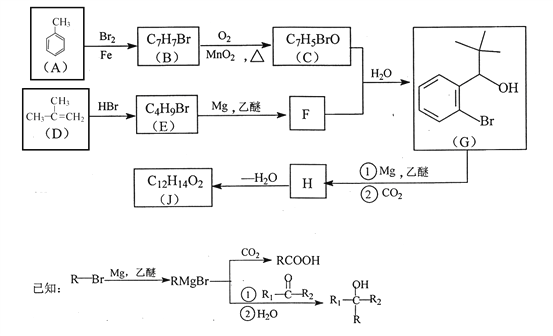
【题目】有机物J 是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
回答下列问题:
(1)B的结构简式是________________。C的结构简式是______________。
(2)D生成 E的化学方程式为_________________。
(3)J的结构简式是________________。在一定条件下,H自身缩聚生成高分子化合物的结构简式是_______________。
(4)根据![]() ,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无一O—O—键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯 为原料,合成![]() 的路线流程图(其它试剂自选):____________________________。
的路线流程图(其它试剂自选):____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是制备硫酸的重要反应。下列说法正确的是
是制备硫酸的重要反应。下列说法正确的是
A.加入催化剂,反应速率加快,反应的![]() 变大
变大
B.将平衡后的混合气体用浓硫酸吸收,剩余的气体只有![]()
C.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
D.若以稀硫酸为电解液,将该反应设计成原电池,放电过程中负极附近溶液的pH不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 1g 氢气完全燃烧生成液态水时放出热量 143kJ,18g 水蒸气变成液态水放出 44kJ 的热量。其他相关数据如下表:则表中 x 为( )
O=O | H-H | H-O(g) | |
1mol 化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
A.920B.557C.463D.188
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com